1. Определить металл X можно по соединению А. Через массовую долю воды в этом соединении определим его молярную массу: M (А) = 18,01528 / 0,0882 ≈ 204,253 г/моль. Как говорил Бритва Оккама:«Не следует множить сущее без необходимости». Последуем его совету и для начала рассмотрим случай, когда из шести лиганд одна - вода. М (X) обозначим за a, а молярную неизвестного лиганда L за b: M (L) = b. Тогда можно составить уравнение, содержащее эти 2 неизвестных:
204,253 = a + 18,01528 + 5 b, тогда получим b = (186,22 - a)/5
Исходя из информации про сильную инертность, мы не рассматриваем все щелочные и щелочноземельные металлы, не рассматриваем и нестабильные и радиоактивные металлы (7 период), не рассматриваем 4 период и 12 группу, так как все металлы в ней нельзя назвать инертными. Металлы 4-й группы (Ti, Zr, Hf) нам не подходят, так как при реакции с галогенами они всегда образуют галогениды состава MX4. 5 группа (V, Nb, Ta) нам не подходит, поскольку каждый металл в ней сгорает до своего высшего оксида – M2O5. По той же причине не подходят и 6 и 7 группы, так как их металлы образуют оксиды состава MO3 и M2O7 при сгорании соответственно. В итоге мы остаёмся с металлами платиновой группы, золотом и серебром. Золото не подходит по условии о нерастворимости в царской водке и по степени окисления +4 в комплексной кислоте. Серебро не подходят потому, что степени окисления +4 оно также не образует. Известный факт, что платина также растворяется в царской водке, а осмий сгорает до тетраоксида OsO4. Остаётся 4 металла – Ru, Rh, Pd, Ir. Подставляя их молярные массы по очереди, мы получаем значения b, равные соответственно 17,03; 16,663; 15,96; -1,1954. Отрицательной молярная масса лиганда быть не может, поэтому наш металл не Ir. Молярная масса в случае Rh слишком неточная, есть более «красивые» варианты – Ru, Pd. В случае палладия это мог бы быть кислород, но для палладия комплекс состава “[Pd(O)5(H2O)]2+” не известен. А вот молярная масса 17,03 хорошо подходит для известного лиганда – молекулы аммиака (NH3). Тогда наш искомый металл (X) – Ru, а соединение А – [Ru(NH3)5(H2O)]2+, что выглядит вполне разумно. Тогда А' – [Ru(NH3)5(N2)]2+, а A'' – [(H3N)5Ru(μ2-N2)Ru(NH3)5]4+, его состав можно предположить исходя из того, что заряд катиона увеличился вдвое.
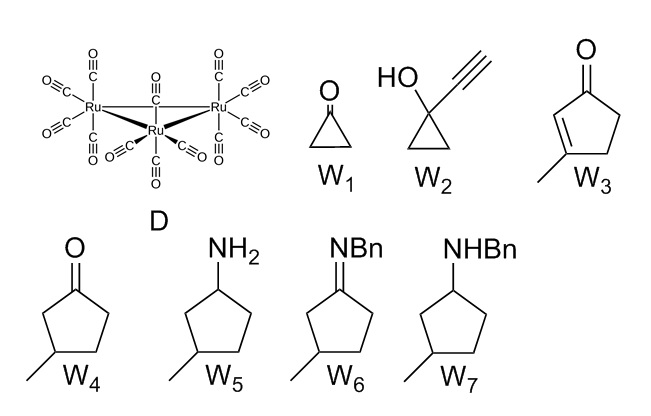
Вещество Z можно отгадать разными способами. Мы знаем, что в эту кислоту входит Ru, а также водород, далее можно рассчитать М (Z) как 101,07/0,32 ≈ 315,84. Сразу вычтем M (Ru), и будем вычитать по атому водорода, оставшееся количество деля на M (Cl) = 35,45 г/моль, сделав предположение о часто встречающемся продукте в реакциях растворения металлов в царской водке – кислоты состава Hx[ЭyClz]. После вычета M (Ru) и 2 M (H), получаем значение ≈ 212,77, что соответствует шести атомам хлора, тогда Z – H2[RuCl6]. Вещество B – RuO2, а вещество C – RuCl3 · nH2O. Вещество F, вероятно, фторид состава RuFm, тогда пусть F' – RuFm-n. Предположим, что F реагирует с иодом в соотношении 1:1, тогда 1/(101,7 + 19m) = 0,8062/(101,7 + 19(m - n)), откуда m = (5,16n - 5,35). Подставляя n = 2, получаем m = 5, следовательно, F – RuF5, а F' – RuF3. Газ U, вероятно, фторид иода, а так как он имеет структуру тригональной бипирамиды, то газ U – IF3 (подходит и IF5). Исходя из плотности по WF6 рассчитаем молярную массу газа, с которым реагирует C: M (газа)= 0,094 * (183,84 + 6*18,9984) = 28 г/моль. Такой молярной массе соответствуют несколько газов – CO, N2, C2H4, B2H6. Удушливыми из них являются CO и B2H6, однако, B2H6 слишком неточен по молярной массе, также образование кластеров более очевидно для CO. Тогда вещество D, вероятно, карбонил. Так как это кластер, то в нем должны быть связи Ru - Ru, вариант с составом (CO)5Ru-Ru(CO)5 не подходит, так как кластеры – это соединения, содержащие минимум три «главных» атома в цикле, так что D – Ru3(CO)12. К тому же известно, что карбонилы такого состава часто образуются элементами 8 группы.
Состав W1 можно отгадать, зная, что диазониевые соли всегда реагируют с отщеплением азота. Следовательно, в веществе W1 его нет. Следующая реакция очень похожа на реакцию Фаворского, тогда, возможно, W1 – кетон. Логично предположить, что количество атомов углерода после реакции останется равным трём, значит, кетон содержит 3 атома углерода, и, исходя из ω(O) = 28,538%, мы понимаем, что W1 –циклопропанон. Тогда W2 – продукт реакции Фаворского –
1-этинилциклопропанол. Сказано, что соединение W3 можно получить внутримолекулярной конденсацией гексадиона-2,5 в кислой среде. Это обычная внутримолекулярная альдольно-кротоновая конденсация, образуется W3 –
3-метилциклопентен-2-он-1. Использование K-selectride с последующей обработкой раствором кислоты приводит к гидрированию двойной связи, W4 –
3-метилциклопентанон-1. Сказано, что W5 можно получить реакцией NH3/H2 на никеле Ренея с W4. Данная смесь используется для восстановительного аминирования кетонов, стало быть, W5 – 3-метилциклопентанамин. Соединение W6 можно получить из W4 обработкой BnNH2. BnNH2 – первичный амин, значит, W6 – имин бензиламина и 3-метилциклопентанона-1. Очевидно, что самые слабые связи в катализаторе Шво – связи с атомами водорода в центре молекулы. Они и будут разрываться, гидрируя имин до амина W7 – (3-метилциклоамил)-бензиламина.
Структурные формулы:
Получить W5 из W4 можно также реакцией Лейкарта-Валлаха, либо же восстановительным аминированием с участием кофермента НАД-Н.