После установления закона постоянства состава химики начали изучать конкретные массовые соотношения, в которых соединяются между собой те или иные химические элементы. Изучение этих соотношений привело к тому, что в начале XIX века английский учёный Дж. Дальтон ввёл в науку понятие об эквивалентах химических соединений. Понятие эквивалент важно для химии прежде всего потому, что на его основе был сформулирован закон эквивалентов:
«элементы соединяются между собой в определённых массовых соотношениях, пропорциональных их эквивалентам».
Впоследствии понятие эквивалент стали применять не только по отношению к отдельным химическим элементам, но и к химическим соединениям в целом. В связи с введением системы СИ, в которой основной единицей количества вещества является моль, претерпело некоторые изменения и понятие эквивалент.
В настоящее время принято следующее определение эквивалента:
Эквивалентом (Э) вещества называется такое его количество, которое в химических реакциях соединяется с 1 моль атомов водорода или замещает его в соединениях.
Размерность эквивалента такая же, как количества вещества: моль.
Например, в реакции
2Н2 + О2 → Н2О
1 моль атомов Н эквивалентен ½ моль атомов О, следовательно, Э(О) = ½ моль.
Масса одного эквивалента вещества называется эквивалентной массой (Мэкв); размерность эквивалентной массы такая же, как молекулярной массы: кг/моль или г/моль. Например, Мэкв (Н) = 1 г/моль; Мэкв (О) = 8 г/моль.
Количество вещества эквивалента (n экв) равно отношению массы вещества (m) к эквивалентной массе: n экв = m/M экв. Например, если имеется 32 г кислорода, то n экв = 32/8 = 4 моль.
Для двух взаимодействующих элементов, ионов или соединений из закона эквивалентов следует, что n экв(А) = n экв(В), тогда
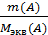 =
= 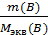
или
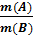 =
= 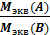
Последняя формула является математическим выражением закона эквивалентов:
массы взаимодействующих элементов, ионов или соединений относятся между собой как молярные массы их эквивалентов.
Молярная масса и эквивалентная масса связаны соотношением:
Мэкв = fэкв ∙ М
где fэкв – так называемый фактор эквивалентности, который для элемента равен 1/В, где В – стехиометрическая валентность элемента в данном соединении; fэкв –величина безразмерная. (Стехиометрическая валентность – формальная валентность, следующая из формулы соединения).
Так, для серы в Н2S (валентность серы равна 2) fэкв = ½ моль и Мэкв (S) = 32/2 = 16 г/моль. Для алюминия в Al2O3 (стехиометрическая валентность алюминия равна трём) fэкв (Al) = ⅓, откуда Э(Al) = ⅓ моль и Мэкв
(Al) = 27/3 =9 г/моль.
Для различных классов неорганических соединений соединений фактор эквивалентности равен:
для оксида
fэкв = 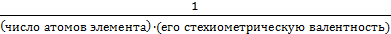
для основания
fэкв = 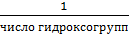
для кислоты
fэкв = 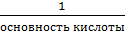
для соли
fэкв = 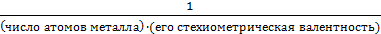
Отсюда следует:
для оксида
Мэкв = 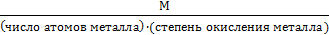
Например: Мэкв (Al2O3) =  = 17 г/моль
= 17 г/моль
для основания
Мэкв = 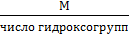
Например: Мэкв (Al(ОН)3) = 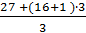 = 26 г/моль
= 26 г/моль
для кислоты
Мэкв = 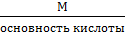
Например: Мэкв (H2SO4) = 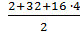 = 49 г/моль
= 49 г/моль
для соли
Мэкв = 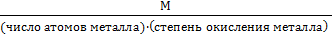
Например: Мэкв (Al2(SO4)3) = 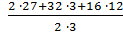 = 57 г/моль
= 57 г/моль
Эквивалентная масса бинарного (состоящего из двух элементов) соединения равна сумме эквивалентных масс составляющих его элементов. Например, Мэкв (СаО) = Мэкв (Са) + Мэкв (О) = 40/2 + 16/2 =28 г/моль; Мэкв (Al2O3) = 27/3 + 16/2 = 17 г/моль. Полученные данные значения аналогичны полученным ранее.
Эквивалент вещества (и, следовательно, его эквивалентная масса) может меняться в зависимости от реакции, в которой это вещество участвует, поэтому необходимо указывать, к какой конкретно реакции относится эквивалент. Например:
1) Н3РО4 + NaOH → NaH2PO4 + H2O
2) Н3РО4 + 2NaOH → Na2HPO4 + 2H2O или
½ Н3РО4 + NaOH →½ Na2HPO4 + 2H2O
3) Н3РО4 + 3NaOH → Na3PO4 + 3H2O или
⅓ Н3РО4 + NaOH → ⅓Na3PO4 + 3H2O
Из соотношений между количествами реагирующих веществ следует, что в первой реакции Э (Н3РО4) = 1 моль, а во второй - ½ моль и в третьей - ⅓ моль. В первом случае М (Н3РО4) = 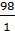 = 98 г/моль; во втором М (Н3РО4) =
= 98 г/моль; во втором М (Н3РО4) = 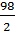 = 49 г/моль; в третьем М (Н3РО4) =
= 49 г/моль; в третьем М (Н3РО4) = 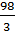 = 32,6 г/моль.
= 32,6 г/моль.
Пример решения некоторых задач:
№ 1 На нейтрализацию 1 г кислоты израсходовано 1,247 г гидроксида калия. Вычислите эквивалентную массу кислоты.
Р е ш е н и е
В соответствии с формулой
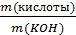 =
= 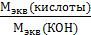
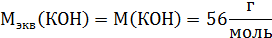
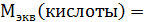
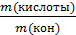 ∙ M (экв)(КОН) =
∙ M (экв)(КОН) = 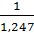 ∙ 56 = 45 г/моль.
∙ 56 = 45 г/моль.