Это максимальная температура в зоне горения, до которой нагреваются продукты горения.
В зависимости от условий, в которых протекает процесс горения различают:
1) калориметрическую
2) теоретическую
3) адиабатическую
4) действительную температуры горения.
Калориметрическая температура горения это температура, до которой нагреваются продукты горения при соблюдении следующих условий:
1) все тепло, выделившееся в процессе реакции, идет на нагревание продуктов горения;
2) происходит полное сгорание стехиометрической горючей смеси, коэффициент избытка воздуха αВ = 1;
3) в процессе образования продуктов горения не происходит их диссоциация;
4) горючая смесь находится при начальной температуре 273К и давлении 101,3 кПа.
Теоретическая температура горения отличается от калориметрической тем, что в расчетах учитываются потери тепла на диссоциацию продуктов горения (при температурах выше 1700оС)
Адиабатическая температура горения определяется для не стехиометрической горючей смеси (αВ ≠ 1)
Действительная температура горения — это температура, до которой нагреваются продукты горения в реальных условиях. Она намного ниже теоретической, калориметрической и адиабатической, т.к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т.д.
Температуру горения используют при расчетах давления взрыва, для определения площади легкосбрасываемых конструкций, температуры пожара и других параметров.
Температура горения зависит от состава горючего материала, условий горения: разбавления продуктов горения избыточным воздухом, температуры воздуха, полноты сгорания исходного горючего материала.
Задача вычисления адиабатической температуры горения сводится к нахождению такой температуры (Т'), при которой наблюдается равенство внутренних энергий исходных веществ и продуктов их горения.
Расчет температуры горения может быть проведен методом последовательных приближений
- Определяем объем и состав продуктов горения
- Находим низшую теплоту сгорания данного горючего вещества
-
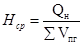 Находим среднее значение энтальпии продуктов горения по формуле
Находим среднее значение энтальпии продуктов горения по формуле
- По табл.1 выбираем, ориентируясь на азот, первую приближенную температуру горения Т 1
5. 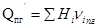 Рассчитываем теплосодержание продуктов горения при температуре Т 1
Рассчитываем теплосодержание продуктов горения при температуре Т 1
- Если Q`ПГ > QН, то T2 < T1 понижаем температуру на 100оС и рассчитываем Q``ПГ
- Расчёт проводим до получения Q``ПГ < QН < Q`ПГ
-
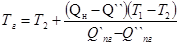 Температуру горения рассчитываем по формуле
Температуру горения рассчитываем по формуле
Если при горении есть избыток воздуха, то он суммируется с V продуктов горения.
Таблица 1
Теплосодержание газов при постоянном давлении
| Температура, °С | Теплосодержание, кДж/моль | |||||
| О2 | N2 | Воздух | СО2 | Н2О | SО2 | |
| 3,0 | 2,9 | 2,9 | 3,8 | 3,3 | 4,1 | |
| 6,0 | 5,8 | 5,8 | 8,0 | 6,8 | 8,5 | |
| 9,1 | 8,8 | 8,9 | 12,5 | 10,4 | 13,2 | |
| 12,4 | 11,8 | 11,9 | 17,3 | 14,0 | 18,2 | |
| 15,7 | 14,9 | 15,1 | 22,3 | 17,8 | 23,3 | |
| 19,1 | 18,1 | 18,3 | 27,5 | 21,7 | 28,5 | |
| 22,5 | 21,3 | 21,5 | 32,8 | 25,8 | 33,9 | |
| 26,0 | 24,6 | 24,8 | 38,2 | 29,9 | 39,3 | |
| 29,6 | 28,0 | 28,2 | 43,8 | 34,2 | 44,8 | |
| 33,1 | 31,3 | 31,6 | 49,4 | 38,6 | 50,3 | |
| 36,8 | 34,8 | 35,1 | 55,1 | 43,2 | 55,9 | |
| 40,4 | 38,2 | 38,6 | 60,9 | 47,8 | 61,5 | |
| 44,0 | 41,7 | 42,1 | 66,8 | 52,6 | 67,2 | |
| 47,7 | 45,3 | 45,6 | 72,7 | 57,4 | 72,8 | |
| 51,5 | 48,8 | 49,2 | 78,6 | 62,3 | 78,4 | |
| 55,2 | 52,4 | 52,8 | 84,6 | 67,3 | 84,1 | |
| 59,0 | 55,9 | 56,4 | 90,5 | 72,4 | 89,8 | |
| 62,8 | 59,5 | 60,0 | 96,6 | 77,6 | 95,6 | |
| 66,6 | 63,1 | 63,6 | 102,6 | 82,8 | 101,2 | |
| 70,4 | 66,8 | 67,3 | 108,6 | 88,1 | 107,1 | |
| 74,2 | 70,4 | 71,0 | 114,7 | 93,4 | 112,7 | |
| 78,1 | 74,1 | 71,7 | 120,8 | 98,8 | 110,5 | |
| 82,0 | 77,8 | 78,4 | 126,9 | 104,2 | 124,2 | |
| 85,9 | 81,5 | 82,1 | 133,0 | 109,6 | 130,0 | |
| 89,9 | 85,1 | 85,9 | 139,1 | 115,1 | 135,8 | |
| 94,0 | 89,0 | 89,3 | 145,3 | 119,4 | 141.6 | |
| 97,9 | 92,6 | 93,1 | 101,5 | 124,8 | 147,3 | |
| 101,8 | 96,4 | 96,8 | 107,6 | 130,3 | 153,0 | |
| 105,1 | 100,5 | 100,5 | 163,8 | 135,8 | 158,8 | |
| 110,1 | 103,8 | 104,2 | 169.9 | 141,2 | 164,7 |
П р и м е р 1. Определить адиабатическую температуру горения этилового спирта в воздухе.
Р е ш е н и е. Расчет проводим по схеме, приведенной выше
1. Так как горючее - индивидуальное вещество, для определения объема и состава продуктов горения запишем уравнение химической реакции горения
C2H5OH + 3O2 + 3×3,76N2 = 2CO2 + 3H2O + 3×3,76N2.
Следовательно, продукты горения состоят из: V( CO2)= 2 моля, V( H2O) =3 моля, V( N2)= 11,28 моля, V ( ПГ)= 16,28 моля.
2. Находим низшую теплоту сгорания данного горючего вещества
ΔН= 2×(-396,9) + 3×(-242,2) – (- 278,2) = -1242,2 кДж/моль.
Q Н = 1242,2 кДж/моль
3. Средняя энтальпия продуктов горения
H ср =1242,2/16,28=76,3 кДж/моль
4. Так как H ср выражена в кДж/моль, по табл. 1 выбираем, ориентируясь на азот, первую приближенную температуру горения Т 1 = 2200 oС.
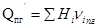 5. Рассчитываем теплосодержание продуктов горения при 2100 оС по формуле
5. Рассчитываем теплосодержание продуктов горения при 2100 оС по формуле
Q ПГ` = 120,8×2 + 98,8×3 + 74,1×11,28 = 1373,8 кДж/моль
6. Сравниваем Q Н и Q ПГ`, так как Q ПГ` > Q Н, выбираем температуру горения на 100оС ниже равную 2100 оС.
7. Рассчитываем теплосодержание продуктов горения при 2100 оС:
Q ПГ`` = 114,7×2 + 93,4×3 + 70,4×11,28 = 1303,7 кДж/моль.
Опять сравниваем Q Н и Q ПГ``, так как Q ПГ`` > Q Н, выбираем температуру горения на 100оС ниже равную 2000 оС.
Рассчитываем теплосодержание продуктов горения при 2000 оС:
Q ПГ``` = 108,6×2 + 88,1,6×3 + 66,8×11,28 = 1235 кДж/моль.
8. Так как Q ПГ``< Q Н< Q ПГ`, определим температуру горения по формуле
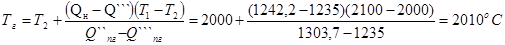 |
Самостоятельное задание. ( выполнить в рабочей тетради после лабораторной работы, прислать на почту mitrofanovanngasu@yandex.ru по 20.04)
Определить, как изменяется калориметрическая температура горения в гомологическом ряду предельных углеводородов (на примере метана, этана, пропана, пентана и гептана). Построить график зависимости температуры горения от молекулярной массы горючего вещества.