Осложнения бронхолегочной дисплазии: легочная гипертензия и легочное сердце
- Дмитрий Юрьевич Овсянников
- Н.О. Зайцева
- А.А. Шокин
- Е.А. Дегтярева
Резюме
В обзоре на основании собственных и литературных данных представлены современные сведения об эпидемиологии, прогнозе, диагностических критериях, этиологии, патогенезе, клиникоинструментальной диагностике, профилактике и терапии грозных осложнений бронхолегочной дисплазии (БЛД) - легочной гипертензии и легочного сердца.
С учетом сильной корреляции между легочной гипертензией/легочным сердцем и выживаемостью детей с БЛД раннее выявление данных осложнений может улучшить прогноз таких пациентов и явиться основанием для более агрессивной респираторной поддержки, назначения вазодилататоров, проведения катетеризаций правых отделов сердца с целью улучшения поздних исходов болезни.
Терминология
Бронхолегочная дисплазия (БЛД), описанная впервые более 40 лет назад у недоношенных новорожденных, длительно находившихся на искусственной вентиляции легких (ИВЛ) в связи с респираторным дистресс-синдромом (РДС), сегодня является самым частым хроническим заболеванием легких (ХЗЛ) в грудном и раннем возрасте. Уже в первом описании болезни W. Н. Northway и соавт. (1967) основной причиной смерти пациентов были легочная гипертензия (ЛГ) и легочное сердце (ЛС) [1].
Согласно новой, Панамской классификации гипертензивной сосудистой болезни легких у детей педиатрической рабочей группы Института изучения заболеваний сосудов легких (PVRI), 2011, критерием наличия ЛГ при БЛД, как и при других вариантах ЛГ, является повышение среднего давления в легочной артерии (СрДЛА) выше 25 мм рт.ст. при индексе резистентности легочных сосудов >3,0 единиц Вуда (WU) ·м2 для ситуации двухжелудочкового кровообращения. В данной классификации вместо термина "легочная гипертензия" предлагается термин "гипертензивная сосудистая болезнь легких" у детей, чтобы исключить пациентов с ЛГ без повышения легочного сосудистого сопротивления (ЛСС), как это наблюдается при обширных контактах между большим и малым кругом кровообращения (при врожденных пороках сердца с септальными дефектами). В Панамской классификации ЛГ при БЛД выделена в отдельную (4-ю) категорию, подчеркивается многофакторный генез поражения сосудов легких у пациентов с БЛД. При БЛД может иметь место ЛГ на почве гипоплазии легких и (или) задержки развития сосудов легких, генетических синдромов, а также ЛГ, связанная с периодической/хронической гипоксией и (или) гиперкапнией из-за повреждения ткани легкого и воздухоносных путей, с диастолической дисфункцией левого желудочка (ДДЛЖ), стенозом легочных вен, с врожденными пороками сердца (ВПС) с системнолегочным шунтом [2]. По нашим данным, частота ВПС у детей с БЛД может составлять 11 % [3].
ЛГ у пациентов с БЛД считается основным патогенетическим фактором развития хронического ЛС - cor pulmonale. Легочное сердце - гипертрофия и дилатация правого желудочка (ПЖ) с возможным развитием правожелудочковой сердечной недостаточности в результате ЛГ, являющейся следствием заболеваний, которые нарушают функцию и (или) структуру легких.
Эпидемиология и прогноз
До настоящего времени БЛД остается самой частой причиной ЛС у новорожденных [4]. Ретроспективные исследования показали, что ЛГ регистрировалась у 25-37 % новорожденных с БЛД [5, 6].
Несмотря на патоморфоз заболевания, все более частое развитие новой (постсурфактантной) формы БЛД, в основе которой лежит гипоплазия альвеол и сосудистого русла легких, ЛГ продолжает оказывать значительное влияние на заболеваемость и смертность детей с БЛД и начинает развиваться в раннем периоде заболевания [7, 8].
В первых описаниях тяжелых случаев БЛД упоминался факт ремоделирования легочных сосудов с исходом в ЛГ, при сохранении ЛГ у детей в возрасте старше 3 мес уровень смертности достигал 40 % [9]. Вместе с тем и в постсурфактантную эру поздняя ЛГ продолжает быть важным фактором низкой выживаемости у детей с новой формой БЛД (последние исследования выявили 70 %-ный уровень смертности у детей с тяжелой ЛГ). Установлено, что выраженная ЛГ является единственным независимым предиктором неблагоприятного прогноза и смерти детей с БЛД.
Короткая продолжительность жизни детей c БЛД связана с продолжительностью выраженной (супрасистемной) ЛГ, когда систолическое давление в легочной артерии (СДЛА) превышает уровень системного артериального давления (САД), 2-летняя выживаемость детей с такой поздней ЛГ составила 47 % [10]. С ЛГ связаны некоторые случаи относительно поздней смерти (после 6 мес) у детей с БЛД, даже при улучшении симптомов ХЗЛ [11].
К сожалению, истинная распространенность ЛГ у детей с БЛД неизвестна; это осложнение либо не принимается во внимание, либо существует его гиподиагностика.
В то же время задержка в диагностике связана с прогрессированием поражения сосудов легких. Диагноз ЛС связан с очень высоким уровнем смертности; обратное развитие поражения легких и сосудов легких на этой стадии заболевания маловероятно.
Патогенез
Ведущими механизмами патогенеза ЛГ у детей с БЛД, являются: 1) гипоплазия сосудистой сети легких; 2) вторичная легочная вазоконстрикция в результате гипоксемии и (или) гиперкапнии; 3) пролиферация и структурное ремоделирование легочных сосудов с прогрессирующей обструкцией и облитерацией легочной сосудистой сети.
Легочное кровообращение у пациентов с БЛД характеризуется, по современным представлениям, патологическим ("дисморфическим") ростом сосудов, включая уменьшение количества легочных артерий малого калибра и нарушение распределения сосудов по отношению к легочной ткани. Уменьшение площади контакта альвеол с капиллярами приводит к нарушению газообмена, что, в свою очередь, увеличивает потребность в кислородотерапии и ИВЛ, вызывая выраженную гипоксемию, повышает риск развития тяжелой ЛГ [12]. Экспериментальные данные показали, что раннее повреждение развивающейся легочной ткани может нарушить ангиогенез. Это, в свою очередь, ведет к уменьшению количества альвеол и их недоразвитию в дистальных участках легочной ткани (так называемая сосудистая гипотеза патогенеза БЛД) [13].
К аномалиям легочного кровообращения у пациентов с БЛД относятся гипертензивное ремоделирование, повышение тонуса сосудов и их реактивности, повышение ЛСС.
Подтверждением увеличенного ЛСС и аномальной вазореактивности у детей с БЛД служит выраженная вазоконстрикция в ответ на гипоксию. Исследования, в которых проводилась катетеризация сердца, показали, что даже легкая гипоксия может вызвать выраженное увеличение давления в легочной артерии (ДЛА) у некоторых новорожденных с БЛД, включая пациентов с незначительным увеличением легочного давления [14]. Дети первых лет жизни реагируют на гипоксию более выраженно, чем взрослые, в связи с тем, что ультраструктурное состояние гладкомышечных клеток сосудов легких у детей примерно до 2-летнего возраста значительно отличается от взрослых [15]. Так, хронические обструктивные заболевания легких у взрослых только в исключительных случаях приводят к повышению ДЛА, более чем половина от системного. У грудных детей с БЛД, напротив, нередко наблюдаются супрасистемные уровни СДЛА [16]. Повышение легочного сосудистого тонуса оказывает влияние на ЛСС даже у более взрослых детей с БЛД без признаков гипоксии. Данный факт позволяет предположить, что патологическое функционирование сосудов легких продолжается даже на поздних стадиях заболевания [17].
Уменьшение темпов сосудистого роста (ангиогенеза) также негативно влияет на площадь поверхности сосудов, вызывая дальнейшее увеличение ЛСС, особенно в ответ на высокие показатели минутного объема при физической нагрузке или стрессе. Для того чтобы в легких происходил нормальный газообмен, необходимы непрерывный рост и поддержание физиологического состояния сложной системы воздухоносных путей и сосудов, включая формирование тонкой, но широкой границы раздела между альвеолами и капиллярами. Нарушение ангиогенеза во время формирования легочной ткани не только увеличивает риск развития ЛГ, но и уменьшает количество альвеол. Замедление роста сосудистого русла легких во время критического периода постнатального роста легких уменьшает количество альвеол, нарушая газообмен между альвеолами и капиллярами, главным образом, за счет влияния сосудистого эндотелиального фактора роста (VEGF). Активация рецептора VEGF (VEGFR) увеличивает экспрессию мРНК и белка эндотелиальной синтазы оксида азота (eNOS), стимулирует освобождение NO, обладающего мощным сосудорасширяющим действием [18]. A. J. Bhatt и соавт. (2001) продемонстрировали ослабление экспрессии в клетках легких мРНК и белка VEGF, а также уменьшение содержания рецептора VEGFR-1 в легких детей, страдающих фатальной БЛД [19].
Гипероксия снижает в легких экспрессию белка (eNOS), VEGF и VEGFR-2 [20]. Ингибирование рецепторов VEGF подавляет альвеоляризацию и рост сосудов, приводя к гистологическим изменениям структуры легких, напоминающим БЛД [21].
С клинической точки зрения уменьшение площади поверхности сосудов означает, что даже относительно небольшое увеличение сброса крови слева направо через открытое овальное окно, дефект межпредсердной перегородки или открытый артериальный проток может привести к более тяжелым гемодинамическим нарушениям у детей с БЛД, чем у новорожденных с нормальным легочным сосудистым рос том [22].
Выраженные бронхиальные и другие легочные коллатеральные сосуды также обнаружены у детей с БЛД во время морфометрических исследований, и их легко обнаружить с помощью катетеризации сердца. Хотя эти коллатеральные сосуды обычно небольшие по диаметру, однако наличие крупных коллатералей может способствовать значительному шунтированию кровотока в легких, приводя к отеку легких и необходимости повышения FiO2.
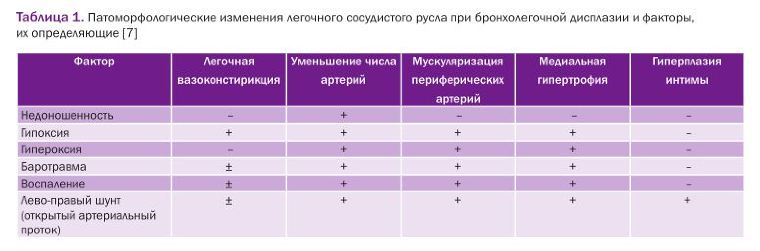
Структурные изменения легочных артерий при БЛД включают пролиферацию интимы, гладкомышечную гипертрофию, распространение фибробластов в глубь сосудистой стенки, миоцитов в дистальные отделы сосудов, утолщение адвентиция, тромбоэмболическую окклюзию [23]. Вызываемая хронической гипоксией чрезмерная мускуляризация сосудов гистологически соответствует таковой при ВПС с гиперволемией малого круга кровообращения. Это сходство может свидетельствовать о частично похожих механизмах в транскрипционной регуляции ремоделирования сосудов в обеих группах пациентов [16]. В основе облитерации сосудов легких при БЛД лежит облитерация бронхиол с переходом хронического лимфоцитарно-нейтрофильного воспаления с бронхиол на артериолы и последующим развитием склероза.
В табл. 1 суммированы патоморфологические изменения легочного сосудистого русла при бронхолегочной дисплазии и влияющие на их развитие факторы.
С учетом гемодинамических переменных, определяющих ЛГ (скорости потока и сопротивления сосудов), патофизиологические последствия острой ЛГ отличны от таковых при хронической ЛГ. Острое развитие ЛГ при отсутствии гипертрофии ПЖ может стать причиной острой правожелудочковой недостаточности.
В норме тонкостенные камеры правого сердца и их высокий комплайенс по отношению к левым камерам существенно меньше зависят от преднагрузки и значительно больше от постнагрузки. Хроническая ЛГ приводит к постепенной гипертрофии и увеличению ПЖ, т. е. развитию сor pulmonale вследствие хронической правожелудочковой постнагрузки. При увеличении массы ПЖ его объем относительно уменьшается, ПЖ меняет полулунную конфигурацию на более сферичную, что описывается в литературе как "лево-вентрикулизация правого желудочка" [24]. И хотя адаптационные механизмы препятствуют развитию супрасистемного давления в ПЖ, при развитии относительной коронарной недостаточности гипертрофированного и дилатированного желудочка и снижении функции левого желудочка развивается функциональная недостаточность ПЖ, подвергающегося хронической перегрузке объемом или давлением. Клиническая картина нередко осложняется развитием нарушений сердечного ритма вследствие поражения синоатриального или атриовентрикулярного водителя ритма [25].
Нарастание ДДЛЖ сопровождается выраженным смещением межжелудочковой перегородки в сторону левой камеры, может приводить к увеличению давления в легочной артерии у новорожденных с БЛД [26]. В одном ретроспективном исследовании до 25 % новорожденных с БЛД и ЛГ, которым проводили катетеризацию сердца, имели гемодинамические признаки ДДЛЖ [27]. Некоторым новорожденным с ДДЛЖ необходимо постоянное назначение курсов диуретиков для лечения рецидивирующего отека легких, при наличии легких форм ЛГ. Увеличение ЛСС в этих случаях ведет к снижению венозного возврата к левому предсердию и развитию бивентрикулярной сердечной недостаточности.
Клиническая диагностика
Клиническая диагностика ЛГ у детей с БЛД затруднена в связи с тем, что проявления ЛГ трудно дифференцировать от проявлений ХЗЛ. Первыми клиническими признаками ЛГ часто являются тахипноэ, диспноэ при нагрузке или синкопе. Данные симптомы являются следствием ограниченной способности увеличивать в условиях покоя еще нормальный сердечный выброс. При этом синкопе является результатом сниженного церебрального кровотока, который еще больше уменьшается в результате индуцированной физической нагрузкой периферической вазодилатации.
Почти у всех пациентов со значительной ЛГ в зависимости от степени тяжести заболевания сосудов легких развивается сопутствующая бронхиальная обструкция [16].
При аускультации сердца выявляется усиление 2-го тона. Если имеется существенная недостаточность легочного и (или) трикуспидального клапанов, то соответственно слышен диастолический или систолический шум.
Расширенные вены шеи с пульсацией (А-волны) являются выражением пониженного комплайенса ПЖ. Пальпаторно усиленные сокращения ПЖ выявляются как следствие правожелудочковой гипертрофии.
S. H. Abman (2011) относит к клиническим признакам ЛГ у детей с БЛД, связанным с более тяжелым течением заболевания, приступы рецидивирующего цианоза, нарушение питания и задержку роста, повторные госпитализации, высокий уровень РаСО2. При выявлении данных признаков необходим скрининг на выявление ЛГ или других сердечнососудистых осложнений; основным методом данного скрининга является эхокардиография (ЭхоКГ) [22].
Одним из проявлений острого ЛС у детей с БЛД являются приступы цианоза (другими причинами данных состояний могут стать обструкция дыхательных путей вследствие трахеобронхомаляции после длительной интубации, инфекции или ишемия миокарда). Дети с тяжелой БЛД во время таких приступов становятся возбужденными, бледно-цианотичными. У некоторых из них отмечается брадикардия, которая может приводить к сердечной недостаточности с быстрым и выраженным ухудшением газового состава крови. Подобные эпизоды корригируются увеличением концентрации кислорода в дыхательной смеси, использованием диуретиков, NCPAP или ИВЛ, если потребуется [28].
Клиническая картина хронического ЛС у детей с БЛД характеризуется развитием истощения, что делает невозможным значительное увеличение сердечного выброса при нагрузке. Гепатомегалия или периферические отеки - это признаки декомпенсируемой нагрузки на правое сердце.
У маленьких детей обращает на себя внимание неспецифичность симптоматики ЛГ в виде усталости или ограничения повседневной активности, что может стать причиной поздней диагностики ЛГ. Тахипноэ и одышка являются основными симптомами у детей раннего и грудного возраста с ЛГ, осложняющей ХЗЛ, так же как при ВПС [16].
Как показали результаты собственного исследования, для оценки тяжести ЛГ у детей с БЛД пригодны возрастспецифические клинические признаки функциональных классов (ФК) ЛГ у детей, представленные в функциональной классификации ЛГ у детей педиатрической рабочей группы PVRI (Панама, 2011 г., табл. 2). Клинически тяжесть ЛГ соответствовала у большинства детей III ФК.
При сопоставлении ФК ЛГ со степенью повышения СДЛА, определенного на основании ЭхоКГ, была установлена прямая количественная зависимость. Дети с ЛС имели IIIa-IV ФК, что позволяет расценивать высокие ФК ЛГ в качестве клинических предикторов развития ЛС [3].

Электрокардиография
Электрокардиография (ЭКГ) мало информативна в ранней диагностике ЛГ у пациентов с БЛД. Это связано с тем, что для появления специфических изменений на ЭКГ гипертрофия ПЖ должна быть значительной. Несколько раньше появляются признаки перегрузки правого предсердия (ПП). В то же время нормальная ЭКГ не исключает наличия тяжелой ЛГ. Электрокардиография имеет недостаточные чувствительность и положительную прогностическую ценность для выявления гипертрофии ПЖ как маркера ЛГ и поэтому не должна использоваться в качестве метода скрининга развития ЛГ [3].
Эхокардиография
Основным неинвазивным методом ранней диагностики ЛГ и динамического контроля эффективности терапии является ЭхоКГ. С внедрением обследования детей с использованием ЭхоКГ ЛГ у пациентов с БЛД стала выявляться намного чаще.
Эхокардиографическим критерием возможной ЛГ, согласно рекомендациям Европейского общества кардиологов (ESC) и Европейского респираторного общества (ERS) по диагностике и лечению ЛГ (2009), является повышение СДЛА до 37-50 мм рт.ст. со скоростью трикуспидальной регургитации 2,9-3,4 м/с, без/с при наличии или при отсутствии дополнительных признаков ЛГ. Точных пороговых значений ДЛА, измеренных методом допплер-ЭхоКГ, в том числе для детского возраста, не разработано [30].
В данном документе представлены рекомендации по диагностике и лечению ЛГ у пациентов с ХЗЛ, в том числе с БЛД, согласно которым обследование пациентов с ЛГ, предложенное для взрослых, должно применяться и у детей. Также у детей можно использовать терапевтический алгоритм, аналогичный применяемому у взрослых (класс рекомендаций IIа, уровень доказательности С).
Для практического использования удобна градация ЛГ, предлагаемая экспертами ВОЗ, согласно которой выделяют две степени тяжести ЛГ в зависимости от величины СДЛА в покое. При легкой степени ЛГ СДЛА находится в пределах 36-50 мм рт.ст. Об умеренной и тяжелой степени говорят, когда данный показатель превышает 50 мм рт.ст. [31].
С помощью ЭхоКГ можно выявить прямые и косвенные признаки ЛГ. К прямым признакам относится повышение ДЛА, определяемое методом импульсно-волновой допплерографии. При отсутствии обструкции выводного отдела ПЖ СДЛА рассчитывается на основании скорости трикуспидальной регургитации (V) и давления в правом предсердии (ДПП) по уравнению Бернулли: систолическое Ppa=4V2+ДПП [30]. Факторы, связанные с ХЗЛ (повышенная воздушность легочной ткани, неправильное положение сердца), усложняют проведение измерения длины струи регургитации через трехстворчатый клапан у детей с БЛД, как и оценку других показателей ЭХО-КГ [32].
Расчет СрДЛА возможен на основании определения временных параметров систолического потока в легочной артерии и рассчитывается по формуле A. Kitabatake (1983): Lg (СрДЛА) = - 2,8 (АТ/ЕТ) +2,4, где АТ - acceleration time, время ускорения потока в выносящем тракте правого желудочка; ЕТ - ejection time, время выброса [31]. Вместе с тем достоверные данные о диагностической ценности этого последнего метода с измерением отношения АТ/ЕТ для выявления ЛГ у детей с БЛД отсутствуют [22]. Определение СрДЛА этим способом у обследованных нами пациентов с БЛД было неинформативно в связи с большой погрешностью при плаче, беспокойстве ребенка во время проведения исследования.
К косвенным эхокардиографическим признакам ЛГ относятся увеличение правых отделов сердца, связанное с их диастолической перегрузкой, дискинезия межжелудочковой перегородки, характеризующая систолическую перегрузку ПЖ, недостаточность легочного и трехстворчатого клапанов [34]. О повышении давления в малом круге кровообращения может свидетельствовать право-левый сброс крови через внутрисердечные шунты. Для длительно существующей ЛГ характерно развитие гипертрофии стенки ПЖ, при хроническом легочном сердце гипертрофии подвергается и межжелудочковая перегородка [24].
Вместе с тем по справедливому заключению S. H. Abman (2011), при отсутствии количественной оценки наличия ЛГ с помощью измерения длины струи трикуспидальной регургитации у пациентов с БЛД качественные характеристики, включая увеличение размеров ПП, гипертрофию и дилатацию ПЖ, дилатацию легочной артерии, уплощение межжелудочковой перегородки, ни в каких сочетаниях не могут обеспечить хорошую прогностическую ценность для выявления ЛГ [22].
Для подтверждения наличия ЛГ у пациентов с формирующейся/сформированной БЛД рекомендуется раннее выполнение ЭхоКГ недоношенным детям с тяжелым РДС, которым необходимы длительная ИВЛ, а также дополнительная кислородная терапия, в особенности с FiO2 >0,3.
В большой степени это касается тех новорожденных, у которых во время беременности развились маловодие и задержка внутриутробного развития плода, являющаяся фактором риска развития тяжелой ЛГ и неблагоприятного исхода [10]. Недоношенные новорожденные с меньшим гестационным возрастом (менее 26 нед) находятся в группе более высокого риска развития поздней ЛГ. Кроме того, на предмет ЛГ должны быть обследованы новорожденные без выраженного клинического улучшения, что проявляется в виде сохранения и (или) усиления потребности в кислородe с высоким FiO2. Другим способом скрининга ЛГ является проведение ЭхоКГ каждому пациенту со среднетяжелой/тяжелой БЛД в 36 недель постконцептуального возраста, то есть нуждающемуся в этом возрасте в кислородотерапии [22]. Выделение перечисленных групп риска развития ЛГ связано с установленной зависимостью между тяжестью БЛД, хронической гипоксемии и ЛГ [3], а также таким специфическим фактором ЛГ у детей с БЛД, как задержка роста сосудистой и альвеолярной ткани легких, зачастую пренатального происхождения, ассоциированная с преэклампсией [35].
Предполагается, что риск развития ЛГ постнатального генеза увеличивается, если ребенок родился с поперечным сечением сосудистого ложа легких ниже 3-го процентиля.
Гипоплазия сосудистой сети легких у детей может стать следствием раннего начала ХЗЛ, что связано с продолжающимся процессом альвеоляризации вплоть до возраста 8 лет [2].
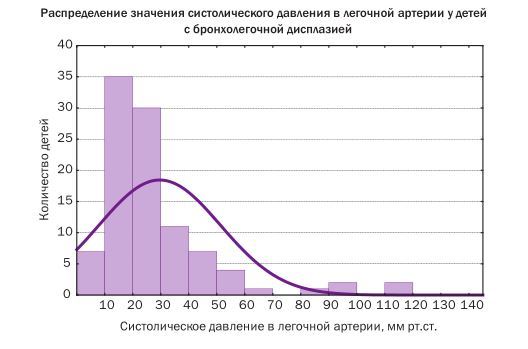
По результатам собственных исследований, при проведении ЭхоКГ 100 младенцам с БЛД частота ЛГ составила 23 %, при этом у 11 % детей СДЛА было в пределах 36-50 мм рт.ст. и у 12 % детей СДЛА превышало 50 мм рт.ст.
У 9 детей с тяжелой БЛД диагностировано ЛС, при этом у всех этих детей СДЛА превышало 50 мм рт.ст. [3]. Частота регистрации различных показателей СДЛА у обследованных пациентов представлена на рисунке.
В недавно проведенном исследовании изучалась ценность эхокардиографических данных для выявления ЛГ у пациентов с БЛД с последующей катетеризацией сердца для измерения ДЛА. Только в 61 % исследований удалось измерить СДЛА. Была выявлена слабая корреляция между ЭхоКГ и катетеризацией сердца для измерения СДЛА. С помощью ЭхоКГ удалось достоверно выявить факт наличия или отсутствия ЛГ в 79 % случаев, однако тяжесть ЛГ была правильно установлена только у 47 % исследуемых. У 7 из 12 детей (58 %), у которых при проведении ЭхоКГ не выявлено признаков ЛГ, впоследствии с помощью катетеризации сердца удалось верифицировать наличие ЛГ [26].
Несмотря на ограниченные возможности, в тех случаях, когда необходимы серийные количественные оценки ЛГ, наиболее доступным инструментом неинвазивного скрининга в настоящее время является допплер-ЭхоКГ.
Данные об эволюции ЛГ у детей с БЛД немногочисленны. Известно, что в течение первого года жизни по мере роста ребенка ДЛА снижается [36]. В исследовании, включавшем 76 детей в возрасте 4-х лет с легкой и среднетяжелой БЛД, при проведении ЭхоКГ средние значения ДЛА определялись на верхней границе нормы [37]. Данные 2-х исследований свидетельствуют о том, что ЛГ является редкостью у старших детей с БЛД в анамнезе, но может обнаруживаться и у бессимптомных больных [38, 39].
Катетеризация сердца и тест на вазореактивность
Проведение катетеризации сердца и теста на вазореактивность рекомендуется пациентам с БЛД в следующих клинических ситуациях:
1) персистирующие признаки тяжелого кардиореспираторного заболевания, не относящиеся напрямую к заболеванию дыхательных путей;
2) вероятная или доказанная ЛГ, несмотря на оптимальное лечение заболевания легких, ЛГ и сопутствующих патологических состояний;
3) подозрение на "непропорциональную" ЛГ, характеризующуюся одышкой, недостаточно объяснимой только поражением легких, показателем СрДЛА ≥40-45 мм рт.ст.;
4) частые эпизоды правожелудочковой недостаточности;
5) рецидивирующий отек легких;
6) отсутствие эхокардиографических критериев ЛГ при наличии клинических признаков, не позволяющих исключить ЛГ;
7) уточнение показаний для назначения хронической специфической терапии ЛГ (вазодилататорами);
8) диагностика ЛГ у кандидатов для хирургического лечения.
Цели катетеризации сердца:
1) оценка тяжести ЛГ;
2) исключение и документирование выраженности ассоциированных анатомических поражений сердца;
3) определение наличия системных и легочных коллатеральных сосудов, обструкции легочных вен;
4) выявление дисфункции левых отделов сердца;
5) оценка реактивности легочных сосудов в тех случаях, когда использование только кислородотерапии не приводит к улучшению состояния пациентов;
6) оценка поражения шунтов, включая измерение степени шунтирования с помощью определения отношения тока крови в легочных сосудах к системному кровотоку [22, 30].
Пациентам с ЛГ и нарушенным вентиляционноперфузионным соотношением, как это имеет место при БЛД, не должны проводиться тесты с внутривенными вазодилататорами и назначаться лечение ими, так как при увеличении легочного шунта и гипоксии может быть спровоцирована "парадоксальная" легочная вазоконстрикция.
В сомнительных случаях тест может быть проведен только с селективно действующими легочными вазодилататорами, такими как кислород, алкалоз, ингаляции NO или илопроста. Кислород является "препаратом выбора" для оценки реактивности сосудов легких, легко и безопасно применимым медикаментом. Кислород, так же как алкалоз, является единственно действенным селективным легочным вазодилататором и системным вазоконстриктором. Воздействие кислорода на сосуды легких у новорожденных и грудных детей сильнее, чем у детей более старшего возраста и взрослых. Если после 5-10-минутной ингаляции кислорода с FiO2 >0,8 отмечается положительная (вазодилатационная) реакция, то никаких дальнейших медикаментозных тестов на вазореактивность не требуется [16].
При проведении катетеризации сердца можно получить и другую чрезвычайно важную для выбора терапевтической тактики информацию. В частности, можно измерить степень шунтирования с помощью определения отношения тока крови в легочных сосудах к системному кровотоку, что может помочь в определении времени закрытия шунтов.
В редких случаях больным с ЛГ и БЛД, получающим вазодилататоры, может потребоваться повторная катетеризация сердца. Основаниями для этого являются:
1) клиническое ухудшение состояния пациента в результате несоблюдения режимов кислородотерапии и медикаментозного лечения или прогрессирующего развития стеноза легочных вен или веноокклюзионной болезни;
2) прогрессирование ЛГ по данным ЭхоКГ;
3) отсутствие адекватной гемодинамической оценки больных в тяжелом состоянии при эхокардиографическом исследовании [22].
Терапия
Комплексное лечение ЛГ при БЛД у детей включает:
лечение основного заболевания, ликвидацию гипоксии, снижение давления в малом круге кровообращения, лечение правожелудочковой недостаточности и сопутствующих заболеваний.
Терапия БЛД в случае развития ЛГ должна быть нацелена на уменьшение гипоксической или гиперкапнической легочной вазоконстрикции и улучшение внутрилегочного газообмена. Для этой цели служат системные и ингаляционные бронходилататоры, кортикостероиды, антибиотики при бактериальной инфекции, а также кислородотерапия [16]. Своевременное эффективное лечение любой инфекции верхних и нижних дыхательных путей особенно важно из-за опасности быстрого ухудшения состояния детей с ЛГ. Профилактика респираторных инфекций крайне важна. Рекомендуется вакцинация от гриппа и пневмококковой инфекции [30]. Для детей с БЛД первых двух лет жизни показана иммунопрофилактика респираторносинцитиальной вирусной (РСВ) инфекции с помощью препарата моноклональных антител к F-протеину РСВ паливизумаба (Синагис). Его применение снижает младенческую смертность, частоту инфекций нижних дыхательных путей и госпитализаций в связи с ними [40].
Терапией выбора и наиболее патофизиологически обоснованным методом терапии пациентов с БЛД, осложненной ЛГ, как и при других вариантах ЛГ, связанной с гипоксемией, является кислородотерапия [30]. Основными эффектами кислорода при ЛГ являются легочная вазодилатация и уменьшение ЛСС. Вазодилатационное действие кислорода на сосудистую систему легких основано на активации калиевых каналов и связанной с ними гиперполяризации гладкомышечных клеток сосудов, а также непосредственном эндотелий-зависимом увеличении продукции эндогенного NO [16].
Пациентам с БЛД и тяжелой ЛГ, которые не могут поддерживать близкий к норме уровень вентиляции или нуждаются в высоких уровнях FiO2, несмотря на проводимое консервативное лечение, предпочтение в стратегии дальнейшего лечения должно отдаваться хронической ИВЛ [22].
Непрерывная долгосрочная кислородотерапия показана пациентам с ЛГ при РаО2 <60 мм рт. ст., при развитии гипоксемии с показателями насыщения кислорода (SatO2) < 94 % [30]. При значениях SatO2 <92-94 % у пациентов с ЛГ развиваются спазм легочных сосудов и ЛГ, впоследствии трансформирующаяся в ЛС. Гипоксемия, как периодическая, так и пролонгированная, является важной причиной персистирующей ЛГ у больных с БЛД.
Поэтому для детей с ЛГ необходимо скорректировать в сторону повышения целевые показатели SatO2, которые существуют в настоящее время и считаются полезными в первые недели жизни для предотвращения развития БЛД [41]. Целевых значений SatO2 92-94 % достаточно для того, чтобы избежать побочных эффектов гипоксии у большинства новорожденных, без увеличения риска дополнительного повреждения и воспаления легочной ткани. Моментальная оценка уровня оксигенации ("контрольная проверка") недостаточна для решения вопроса о количестве необходимого кислорода для терапии.
В этой связи очень важно проведение продолжительной пульсоксиметрии [23].
Использование кислорода у больных с хронической гипоксемией должно быть постоянным, длительным (не менее 15 ч/сут) с продолжительной пульсоксиметрией, и, как правило, проводиться в домашних условиях.
Поэтому такая форма терапии называется "длительной домашней кислородотерапией". Эффекты домашней кислородотерапии у детей с БЛД, помимо уменьшения степени ЛГ, правожелудочковой сердечной недостаточности, одышки, включают улучшение роста и репарации легких, качества жизни, профилактику развития ЛС и внезапной младенческой смерти [42]. Перед назначением больным длительной кислородотерапии необходимо убедиться, что возможности медикаментозной терапии БЛД исчерпаны, и максимально возможная терапия не приводит к повышению уровня SatO2 выше пограничных значений [43]. Для проведения длительной кислородотерапии в домашних условиях в настоящее время наиболее широко применяются концентраторы кислорода.
В кислородотерапии нуждаются также пациенты с БЛД, осложненной ЛГ и гипоксемией, во время авиаперелетов [44].
Специфической терапии ЛГ, связанной с БЛД, в настоящее время не существует. Несмотря на частое использование вазодилататоров в лечении ЛГ при БЛД, данных, указывающих на их эффективность, очень мало. Поэтому назначать такие препараты следует только после тщательного диагностического обследования пациента и активного лечения основного заболевания легких и сопутствующих заболеваний. Некоторые авторы не рекомендуют использование ЛГ-специфической лекарственной терапии у пациентов с ЛГ, обусловленной заболеваниями легких, в связи с небольшой доказательной базой о ее безопасности и эффективности [30]. Одним из объяснений этого является усиление гипоксемии из-за ухудшения вентиляционно-перфузионного соотношения у пациентов с заболеванием паренхимы легких на фоне внутривенной или пероральной терапии вазодилататорами.
К современным методам медикаментозного лечения ЛГ у больных с БЛД относятся: 1) ингаляции NO; 2) ингибиторы фосфодиэстеразы-5; 3) антагонисты рецепторов эндотелина; 4) блокаторы кальциевых каналов; 5) простациклин и его аналоги; 6) ингибиторы ангиотензинпревращающего фермента (АПФ).
У новорожденных с подтвержденной БЛД инагаляции NO вызывают селективную легочную вазодилатацию и улучшают оксигенацию [37, 45]. Несмотря на то что больным с БЛД проводилась длительная терапия NO в виде ингаляций, особенно в тех случаях, когда требовалась непрерывная ИВЛ, данных, указывающих на эффективность такой терапии, нет. Хотя терапию ЛГ с помощью таких ингаляций часто начинают в дозе 10-20 ppm, большинство пациентов впоследствии хорошо переносят уменьшение дозы до 2-3 ppm, что, в свою очередь, улучшает вентиляцию и перфузию, а следовательно, при более низком уровне FiO2 достигается лучшая оксигенация [22].
В лечении ЛГ у новорожденных детей и детей более старшего возраста с БЛД в последнее десятилетие используется силденафил [46]. Силденафил является мощным селективным ингибитором цГМФ-специфической фосфодиэстеразы типа 5. Ее ингибирование сопровождается накоплением цГМФ в гладкой мускулатуре сосудов легких, что приводит к их расслаблению и вазодилатации.
При моделировании БЛД на животных моделях было установлено, что применение силденафила снижает ЛГ и улучшает рост альвеол легких, поврежденных гипероксией.
При применении силденафила также улучшался ангиогенез, снижалось ЛСС, уменьшалась гипертрофия миокарда ПЖ и межжелудочковой перегородки [47]. Использование силденафила у новорожденных находится в стадии накопления опыта и рассматривается как метод терапии стойкой ЛГ, рефрактерной к стандартной терапии, в особенности при отсутствии доступа для проведения ингаляций NO и экстракорпоральной мембранной оксигенации.
Рекомендуемые дозы - 0,3-1,0 мг/кг каждые 6-12 ч [46].
Опубликованы данные об опыте применения препарата в более высоких дозах, рекомендуемая при этом начальная доза силденафила составляет 0,5 мг/кг каждые 8 ч.
При отсутствии системной артериальной гипотензии доза может быть постепенно увеличена в течение двух недель до достижения желаемых значений ДЛА или до максимальной дозы 2 мг/кг каждые 6 ч [22]. В исследовании 25 младенцев с ХЗЛ и ЛГ, из которых 18 страдали БЛД, пролонгированная до 28-950 дней терапия силденафилом в дозе 1,5-8,0 мг/кг/сут в комплексной терапии ЛГ сопровождалась эхокардиографическим и клиническим улучшением у большинства (88 %) больных без значимых побочных эффектов [48]. Собственные результаты лечения младенцев с БЛД, осложненной ЛГ, также продемонстрировали высокую клинико-инструментальную эффективность и безопасность терапии силденафилом [3].
По нашему мнению, возможность назначения силденафила должна рассматриваться при наличии клинических показаний, неэффективности кислородотерапии и СДЛА >50 мм рт.ст. (по данным допплер-ЭхоКГ).
Ретроспективное исследование показало, что применение антагониста рецепторов эндотелина бозентана (Траклира) может быть эффективным и безопасным у детей с ЛГ в возрасте старше 9 месяцев, но имеющиеся возрастные о<