Пигменты как составная часть фотосинтетического аппарата, часто используются для определения реакции растения на воздействия внешней и внутренней среды растения (при болезнях) для оценки его продуктивности и количественного связывания атмосферного углерода в его биомассе. В растении с уществует несколько групп пигментов: фотосинтетические, принимающие непосредственное участие в процессе фотосинтеза, и накапливающиеся в пластидах фотосинтезирующих клеток, антоцианы, содержащиеся в межклетниках или в стенках клеток растения и не принимающие непосредственного участия в фотосинтезе. Если первые образуются в процессе формирования растения при участии фермента хлорофилазы и световой энергии, то антоцианы образуются, как правило, в осенних листьях растений под действием яркого солнечного света и низких (вплоть до отрицательных) температур, придающие листьям осеннюю раскраску (в основном красную). Желтая окраска осенью у лиственных и хвойных пород свидетельствует об осеннем разрушении в них зеленых пигментов.
Имеется несколько методов определения концентрации пластидных пигментов, содержащихся в пластидах (хлоропластах) фотоситезирующих клеток растений: метод бумажной хроматографии, спектрофотометрический, тонкослойной хроматографии, разделительных ионнобменных смол и др. Мы рассмотрим два первых.
Метод бумажной фотографии (И.А.Попова «Исследования пигментов пластид с помощью хроматографии на бумаге //Л.: Тр. БИН СССР, 1963. Вып. 16. С. 154-164; Сапожников и др., 1956, 1959) основан на использовании свежего или высушенного растительного материала. Определяются следующие пигменты: хлрофилл «а», хлорофилл «b», каротин, лютеин, виолаксантин, неоксантин. Вначале готовится журнал для необходимых записей. Для определения концентрации пигментов берется навеска 0,5 г свежей хвои (одновременно берется навеска материала также на влажность). Для листьев, содержащих высокую концентрацию пигментов, в опыте можно использовать и меньшие навески листьев. Опытный материал помещается в небольшую фарфоровую ступку, к нему добавляется небольшое количество (на кончике скальпия) щелочи СаСО3 или МgСО3 для нейтрализации кислот (для предотвращения феофонизации), и небольшое количество стеклянного порошка для улучшения растирания. Вся масса растительного материала тщательно фарфоровым пестиком растирается с постоянным добавлением к ней небольших порций растворителя (этанола и ацетона в соотношении 1:3). После окончания растирания образовавшаяся масса тщательно тем же растворителем промывается до полного обесцвечивания, раствор переносится в мерный цилиндр на 250 мл, показания заносятся в специальный журнал. После этого раствор отфильтровывается на стеклянном фильтре № 3. Разделение пигментов проводится восходящим током растворителя с использованием хроматографической бумаги. Для этого с помощь мерной пипетки берется 1 мл фильтрата и тонкой линией в виде тонкой полоски наносится внизу хроматографической бумаги. Для разгона пигментов используется хроматографическая бумага «ленинградская быстрая» Ленинградской бумажной фабрики. Размер хроматограммы стандартный 17х19 см. После окончания нанесения и просушки в воздухе над комнатным винтилятором, хроматограмма помещается в специальный цилиндр для разгонки, в который предварительно наливается 40 мл растворителя. Растворителем служит смесь ацетон: петролейный эфир: бензин (калоша) в соотношении 7:5:17. Стакан плотно закрывается притертой крышкой и помещается в затененное место (вытяжной шкаф со шторами). Через 30-40 мин, когда фронт растворителя подойдет к верхней части хроматограммы и будет наблюдаться четкое разделение пигментов, хроматограмма из стакана извлекается и просушивается комнатным винтилятором. Затем окрашенные полосы соответствующие на бумаге определенным пигментам (в самой верхней части хроматограммы располагается хлорофилл «а», затем ниже его хлорофилл «b», в самом внизу располагаются каротиноиды: каротн, лютеин и виолаксантин, на стартовом пятне остается неоксантин) разрезаются, измельчаются и помещаются в соответствующие пробирки для перевода пигментов с бумаги в раствор и заливаются серным эфиром. Извлечение пигментов с бумаги продолжается до полного обесцвечивания бумаги. Оптическую плотность полученной вытяжек пигментов, содержащих каротин, лютеин, виолаксантин и неоксантин промеряют на ФЭК-М за синим светофильтром, каротиноиды – за красным светофильтром. Концентрацию пигментов определяют по калибровочным кривым, построенными по набору стандартных растворов известной концентрации пигмента, полученной на данном приборе (на ФЭК-М) отдельно для каждого пигмента (на оси абцисс откладывается объем элюата в мл, на ординате оптическя плотность элюата, полученная на ФЭК) и рассчитываем по формуле Веттштейна. Ниже приведен пример расчета содержания пигментов у подроста ели.
Таблица. Концентрация пигментов в хвое подроста ели в 59 летнем березняке
| Пигменты | Объем элюата, мл | Показания ФЭК | Концентрация, мг | Содержание, мг |
| Хлорофилл «а» | 0,40 | 617,4 | ||
| Хлорофилл «b» | 0,78 | 669,8 | ||
| Каротин | 0,48 | 89,6 | ||
| Лютеин | 3,15 | 166,0 | ||
| Виолаксантин | 3,80 | 94,1 |
Спектрофотометрический метод. Этот метод считается наиболее точным, перспективным и удобным при использовании, значительно сокращающий трудоемкость работ и расход дорогостоящих химических препаратов. Его содержание подробно описано в работах А.А. Шлык «Определение хлорофилла и каротиноидов в экстрактах зеленых листьев //Биохимические методы в физиологии растений. М.: Наука, 1971. С. 159-169». В.Ф. Гавриленко, М.Е. Ладыгина, Л.М. Хандобина //Большой практикум по физиологии растений. Фотосинтез. Дыханиею М.: Высшая школа, 1975. 192 с. Для опыта берутся свежесобранные листья (хвоя) от 3-5 растений, часть которых (1-3 г) в виде смешанной пробы непосредственно на ПП взвешиваются на торсионных весах ВТ-500 или ВТ-1000 и консервирются в пробирках небольшим количеством раствора либо ацетона, либо этанола. Обычно берется несколько повторных образцов с целью исключения возможной ошибки. Пробирки в пламени спиртовки нагреваются до кипения, затем помещаются в банки для охлаждения холодной водой либо льдом. После охлаждения пробирки закрываются пробкой из пробкового материала (использование каучуковых пробок невозможно из-за возможной диффузии их содержимого в опытный раствор и искажения данных), фиксируются разогретым парафином и доставляются в лабораторию. В лаборатории содержимое из пробирки извлекается, переносится в фарфоровую ступку и с помощью фарфорового пестика с добавлением небольшого количества (на кончике скальпия) щелочи (СаСО3, либо МgСО3) и стеклянного порошка тщательно растираются с постоянным добавлением использованного при фиксации растворителя. После полного растирания образец растворителем тщательно промывается до полного обесцвечивания. Полученный элюат переносится на стеклянный фильтр № 3 и фильтруется. После окончания фильтрования элюат переносится в мерный цилиндр на 100 или 50 мл, замеряется его объем и сливается в освободившуюся из-под него пробирку. Затем начинается промер плотности элюата на спектрофотометре. Для определения концентрации пигментов в отечественных лабораториях чаще всего используются спектрофотометры ленинградской фирмы «ЛОМО». Берутся две кюветы (поставляемые фирмой вместе с прибором) объемом по 2 мл, которые после наполнения помещаются в прибор для проработки: одна контрольная, в которую заливается чистый растворитель, который был использован для консервирования растительного материала. Во вторую кювету наливается испытуемый раствор (элюат) опытного образца. Затем начинается промер плотности раствора на следующих длинах волн: 665, 649, 440,5, соответствующих длинам волн поглощения соответствующим пигментом. Концентрацию пигментов в исходном материале определяем с применением соответствующих формул, приводимых в выше указанных работах. Измерение концентрации пигментов в исходных образцах проводится в трех биологических и двух аналитических повторностях. Концентрацию пигментов (хлорофиллов а и b, их суммарное содержание рассчитывается по формулам Вернона (Шлык, 1971; Гавриленко и др., 1976).
СХЛ.а = 11,63 D665 – 2,39 D649
CХл. b = 20,11 D 649 – 5,18 D665,
СХл (а + b) = 6,45 D665 + 17,72 D649
Концентрацию пигментов в исследуемом материале устанавливали по формуле: А= С۰V / Р۰1000
где: С – концентрация пигментов, мг/л,
V – объем вытяжки пигментов, мл,
Р – навеска растительного материала, г,
А – содержание пигментов в исходном материале, мг/г свежей массы.
Результаты выражаются в мкг на 1 г свежей массы хвои. Если при извлечении пигментов использован этанол, то для определения этим методом каротиноидов, для них готовится специальный раствор из ацетона. Т ьаким же образом осуществляется определение их концентрации. Ниже дается пример содержания пигментов в хвое подроста ели в лиственных насаждениях, определенных данным методом.
Влияние выборочной рубки на концентрацию пигментов
(мкг в 1 г свежей массы хвои) у подроста ели (высота 1,5-1,7 м)
в березняках и осинниках черничных
| Пигмент | Контроль | Вырубка (45-50 % запаса) | ||||
| 53-летн березн. | 59-летн. березняк | 53-летн. осинник | 53-летн. березняк | 59-летн. березняк | 53-летн. осинник | |
| Хлорофилл а | 680  8 8
| 718  12 12
| 814  17 17
| 580  9 9
| 618  14 14
| 640  11 11
|
| Хлорофилл b | 266  4 4
| 295  3 3
| 384  6 6
| 200  3 3
| 212  4 4
| 230  3 3
|
| Сумма (a+b) | 946  12 12
| 1013  18 18
| 1198  9 9
| 780  14 14
| 830  16 16
| 870  17 17
|
| Хл. a/ Хл b | 2,56 | 2, 43 | 2,12 | 2,90 | 2,98 | 2,78 |
| Каротиноиды | 126  2 2
| 135  2 2
| 160  4 4
| 130  3 3
| 136  4 4
| 140  2 2
|

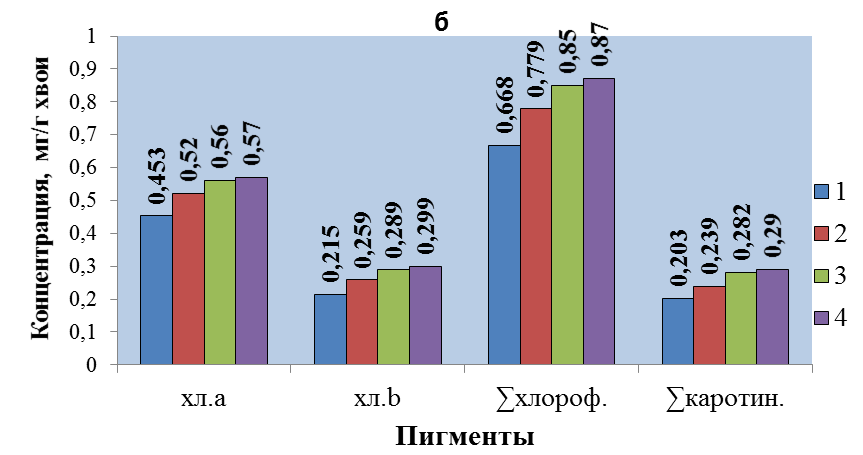
Рисунок 2. Концентрация хлорофиллов и каротиноидов в разновозрастной хвое: a - Pinus contorta, дендропарк ст. Исакогорка; б - Pinus sylvestris, о/у «Зубово». Возраст хвои: £ -1 год, £ – 2 год, £ – 3 год, £ – 4 год.
Содержание хлорофиллов а и b в светособирающем комплексе (ССК) и хлорофилл-белковых комплексах фотосистем I и II (ХБК ФС1 и ФСII) расчитывается исходя из того, что практически весь хлорофилл b содержится в ССК, а соотношение Хл. а /Хл. b в этом комплексе составляет 1,1-1,3 (Рубин и др., 1988; Кирпичникова и др., 1985). Необходимость проведения таких расчетов диктуется теми соображениями, что стационарные уровни содержания хлорофиллов и их соотношения в ССК/ХБК закономерным образом изменяются при изменении экологических условий местообитания растений, что позволяет рассматривать данные характеристики ассимиляционного аппарата в качестве важных и перспективных для оценки состояния ассимиляционного аппарата растений в условиях меняющейся экологии (Рубин, 1988).
Оценка ежегодного фотосинтетического стока углерода проводится по хлорофилловому индексу (сумма хлорофилла для всего растения, ХИ), который вычисляется как средний из трех-пяти биологических повторных определений, взятых в отдельности для каждого возраста хвои или листьев. После определения в них концентрации хлорофилла делается перерасчет его на всю массу ассимилирующих органов среднего дерева. Хлорофилловый индекс, полученный вначале для модельного дерева, а затем определяется для всего древостоя (с учетом всего количества деревьев, имеющихся на одном га площади), перемножается на соответствующий коэффициент – для ели 111 (Цельникер, Малкина, 1994; Воронин и др., 1995) и вычисляется общий ежегодный сток углерода для всего насаждения.
Таблица 2. Хлорофилловый индекс и ежегодный сток атмосферного углерода
сосны скрученной на участке дендрологического парка, 2003 г.
| Возраст хвои | Масса свежей хвои, кг | Хлорофилловый индекс | Сток углерода | |||||
| 1 г хвои, мг | всех деревьев, г | % | 1 г хвои, г | 1 деревом, г | всего, кг | % | ||
| 1 год 2 года 3 года 4 года | 0,591 0,702 0,757 0,792 | 55,1 33,9 9,5 1,5 | 0,1454 0,1727 0,1862 0,1948 | 80,67 49,60 14,00 2,07 | 55,1 33,9 9,5 1,5 | |||
| Всего | – | – | 146,34 |
Концентрация углерода в отдельных компонентах фитомассы определялась весовым методом в сухом материале с использованием стандартной рекомендации Миттхевса (цит.: Швиденко и др., 2000) путем перерасчета полученной величины массы органа на соответствующий коэффициент: для зеленых частей 0,45, для древесины 0,50.
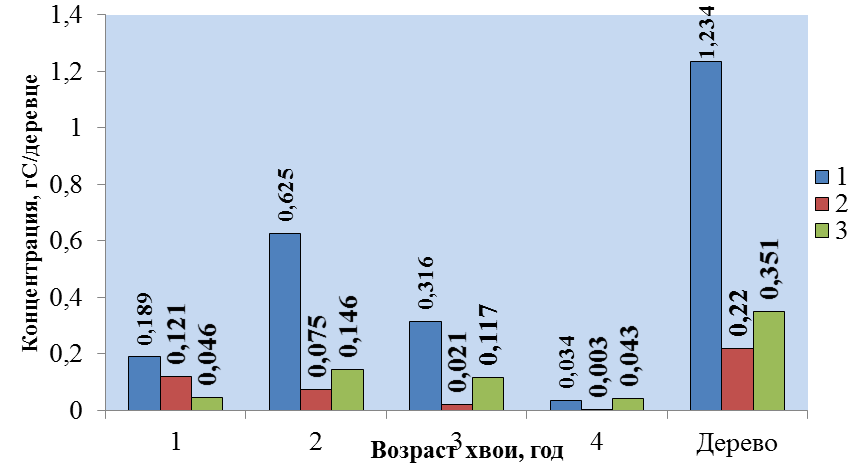
Рис. 4 – Ежегодный сток атмосферного углерода в разновозрастной хвое: Pinus contorta £ -лесопитомник “Караси”, £ - дендропарк ст. Исакогорка; Pinus sylvestris £ - лесопитомник “Караси”.