ВВЕДЕНИЕ
Дисперсные системы – это гетерогенные системы, состоящие из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Обычно одна из фаз образует непрерывную среду, её называют дисперсионной средой. В объёме этой фазы распределено какое-либо вещество - дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов, твёрдых аморфных частиц, капель или пузырьков.
ОСНОВНЫЕ ТИПЫДИСПЕРСНЫХ СИСТЕМ
По дисперсности, т.е. размеру частиц дисперсной фазы дисперсные системы делят на взвеси (суспензии и эмульсии) и коллоидные системы.
Взвеси – это дисперсные системы, в которых размеры распределённых частиц (частицы дисперсной фазы) сравнительно велики (10-7 – 10-5 м). Взвеси делятся на суспезии и эмульсии. В суспезиях распределённое вещество твёрдое, а в эмульсиях – жидкое. Частицы взвесей видны простым глазом или в обычный оптический микроскоп. Поэтому взвеси представляют собой мутные системы. Взвеси неустойчивы, если диспергированное вещество в них имеет бóльшую плотность, чем дисперсионная среда, то диспергированное вещество постепенно выпадает в осадок. Если его плотность меньше плотности среды – оно, наоборот, всплывает. Например, если смешать глину и воду, то через некоторое время глина постепенно будет оседать на дно сосуда. Если же смешать воду и масло, то масло, наоборот, будет всплывать на поверхность и собираться там. Первый процесс называется седиментацией (для суспезий), второй расслоением (для эмульсий). Суспензии легко разделяются фильтрованием через обычную фильтровальную бумагу, смеси можно быстро разделить в центрифуге.
Коллоидные системы (или коллоидные растворы) – это гетерогенные дисперсные системы, в которых частицы распределённого вещества имеют размеры порядка 10-9 – 10-7 м или от 1 до 100 нм. Суммарная поверхность системы, состоящей из частиц такого размера, достигает необычайно большой величины. Например, 1 г вещества при размере частиц 10-8 м будет иметь поверхность порядка нескольких сотен квадратных метров. Каждая частица может содержать большое число атомов или молекул. Однако, такие частицы не видны ни простым глазом, ни в оптический микроскоп, но они (частицы) образуют отдельную фазу.
Следует отметить, что если диспергированное вещество распределено в среде в виде молекул или ионов (размер частиц 10-10 – 10-9 м), то система является истинным раствором (или просто раствором). В данном случае граница (поверхность раздела) между растворённым веществом и растворителем отсутствует, так как понятие поверхности раздела неприменимо к отдельным атомам, молекулам и ионам. Истинный раствор представляет собой гомогенную (однородную) систему.
Дисперсные системы ещё классифицируют по способности частиц дисперсной фазы взаимодействовать с дисперсионной средой (растворителем) с помощью понятий лиофильность и лиофобность.
Лиофильность (если дисперсионной средой является вода, то гидрофильность) означает хорошее смачивание коллоидных частиц, т.е. в таких системах на поверхности частиц имеется уплотнённый слой молекул растворителя. В лиофильных системах наблюдается усиление межмолекулярного взаимодействия между дисперсионной средой и дисперсной фазой. Межфазное поверхностное натяжение очень. Лиофильные дисперсные системы термодинамически равновесны, они всегда высокодисперсны, образуются самопроизвольно и при сохранении условий их возникновения могут существовать сколь угодно долго. Согласно первому и второму началам термодинамики для равновесных процессов можно записать
∆G= ∆Н - Т∆S, или dG = d H – T d S
где ∆G (d G), ∆Н (d H) и ∆S (d S) – изменение энергии Гиббса, энтальпии и энтропии соответственно.
Лиофобность (для воды гидрофобность) означает, что на поверхности дисперсных частиц нет уплотнённого слоя из молекул растворителя (молекул дисперсионной среды). В лиофобных дисперсных системах межмолекулярное взаимодействие между дисперсионной средой и дисперсной фазой значительно. Граница раздела фаз выражена достаточно чётко.
СПОСОБЫПОЛУЧЕНИЯ ЛИОФОБНЫХ КОЛЛОИДНЫХ СИСТЕМ
Образование дисперсных систем возможно двумя путями: диспергационным и конденсационным.
Диспергирование – это тонкое измельчение твёрдого тела или жидкости, в результате которого образуются дисперсные системы: порошки, суспензии, эмульсии, аэрозоли.
Лиофобные коллоидные системы получают путём дробления крупных кусков вещества до частиц коллоидных размеров. Измельчение веществ проводится в инертной среде. Диспергирование не является самопроизвольным процессом. Распространённым методом диспергирования является удар или истирание твёрдых тел. Такой метод воздействия на твёрдые вещества приводит к измельчению твёрдых тел.
Конденсационные методы – это способы получения коллоидных систем путём объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. При этом система из гомогенной превращается в гетерогенную.
Конденсационные методы классифицируют по природе сил, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию.
Физическая конденсация осуществляется при понижении температуры газовой среды, содержащей пары различных веществ. При понижении температуры пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу. Примером может служить образование атмосферного тумана, представляющего собой мельчайшие капельки воды, образовавшиеся путём конденсации влаги воздуха в результате его охлаждения.
Примером физической конденсации является метод замены растворителя: раствор какого-либо вещества постепенно при перемешивании, прибавляют к жидкости, в которой это вещество нерастворимо, т.е. идёт процесс ухудшения качеств растворителя. Этим способом получают гидрозоли серы, фосфора, холестерина, канифоли, антрацена и других веществ, вливая их спиртовые растворы в воду.
При получении коллоидных систем путём химической конденсации вещество, образующее дисперсную фазу, получается в результате химической реакции
Методы химической конденсации очень разнообразны, рассмотрим некоторые из них.
1. Восстановление. Важнейшим химическим методом является восстановление в отсутствии или в присутствии высокомолекулярных веществ.
В основе метода лежат следующие химические реакции:
2HAuCl4 + 3H2O2 → 2Au↓ + 8HCl + 3O2
или
2HAuCl4 + 3HCHO + 11KOH → 2Au↓ + 3HCOOK + 8KCl + 8H2O
2. Окисление. Примером может служить реакция окисления сероводорода сернистым газом:
2H2S + SO2 → 3S↓ + 2H2O
3. Реакции обмена. Если продукт реакции не является электролитом, то эта реакция даёт возможность просто получить коллоидный раствор. Например:
As2O3 + 3H2S → As2S3↓ + 3H2O.
Избыток одного из реактивов обеспечивает устойчивость системы.
4. Гидролиз. Этот метод широко применяется для получения золей гидроксидов металлов. Так, золь гидроксида железа получается при нагревании раствора соли железа по реакции:
FeCl3 + 3H2O → Fe(OH)3↓ + 3HCl.
Степень гидролиза возрастает с увеличением температуры и с увеличением разведения.
ФИЗИКО-ХИМИЧЕСКОЕ ДРОБЛЕНИЕ ОСАДКОВ (ПЕПТИЗАЦИЯ)
Переход осадка во взвесь под влиянием физико-химичесих воздействий носит название пептизации. Подвергаемый пептизации осадок должен содержать частицы коллоидных размеров и не требовать затраты энергии на дробление осадка. пептизация – это нарушение связей между слипшимися частицами осадка и перевод этих частиц в дисперсионную среду. Для того, чтобы осадок мог быть пептизирован, должны выполняться следующие условия:
· частицы, содержащиеся в осадке, должны сохранить свою индивидуальность и не образовывать прочных агрегатов;
· частицы осадка должны обладать некоторым зарядом или сольватной оболочкой.
При наличии этих факторов осадки пептизируются.
При адсорбционной пептизации к осадку добавляются ионы, которые адсорбируются на частицах, придают им определённый заряд. Например, при адсорбционной пептизации свежеприготовленные «осадки» Fe(OH)3, Al(OH)3, AgCl и др. имеют частицы коллоидных размеров. Поэтому, чтобы перевести их в дисперсионную среду, к таким «осадкам» прибавляют вещество – пептизатор. Так, например, для Fe(OH)3 в качестве пептизатора используют раствор FeCl3 или раствор олеата натрия, многоатомные спирты и др. вещества. Осадок AgCl пептизируют раствором AgNO3. При добавлении пептизатора частицы приобретают заряд и отталкиваются друг от друга.
Пептизация при промывании осадка заключается в том, что из системы удаляются ионы, вызывающие снижение устойчивости системы. Концентрация в растворе такого электролита уменьшается, силы электростатического отталкивания частиц начинают действовать на более далёких расстояниях и, поэтому, частицы «осадка» переходят в дисперсионную среду – образуется коллоидная система.
Пептизация путём поверхностной диссоциации связана с тем, что добавляемый пептизатор, вызывает образование растворимых соединений на поверхности частиц. Так, для пептизации осадка Al(OH)3 добавляют слабый раствор HCl (или NaOH). Образующиеся при этом ионы Al 3+ пептизируют осадок гидроксида алюминия.
СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ
Существует правило Фаянса-Панета, которое даёт нам указание о направлении адсорбции:
на поверхности ядра мицеллы адсорбируются преимущественно
те ионы,которые имеют с ядром общие химические элементы.
Рассмотрим в качестве примера образование коллоидной системы хлорида серебра при избытке раствора хлорида калия. Коллоидная частица, образующаяся при взаимодействии нитрата серебра с большим избытком хлорида калия, имеет сложное строение и её называют мицеллой. Строение мицеллы можно представить следующей формулой:
ГРАНУЛА
______________ _____________
{[(AgCl)m ∙ nCl ‾ ∙ (n – x) K +] ∙ xK +} 0
кристалл внутренняя противоионы противоионы
(ядро) обкладка плотного слоя диффузного слоя
___________________________________ ________________________________
МИЦЕЛЛА
В центре мицеллы находится ядро (AgCl). Ядро инертно по отношению к дисперсионной среде, не растворяется в ней и не подвергается сольватации (нет сольватной оболочки). Количество молекул, образующих ядро, обозначают через m. На поверхности ядра согласно правилу Фаянса-Панета, может идти адсорбция ионов. Эти ионы придают определённый заряд ядру (в нашем случае отрицательный). Поэтому эти ионы называют потенциалопределяющими ионами. Ионы калия, имеющие противоположный заряд, за счёт сил электростатического притяжения собираются около адсорбированных на поверхности ядра ионов хлора. Следовательно, около кристалла (ядра) концентрируются ионы противоположного знака. Эти ионы называются противоионами.
При х = 0 коллоидная частица будет находиться в состоянии, которое называют изоэлектрическим состоянием (заряд коллоидной частицы равен нулю). Это состояние можно записать так:
[(AgCl)m ∙ nCl ‾ ∙ nK +] 0
Приведем схему строения мицеллы берлинской лазури, полученной по реакции
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
при условии, что в избытке взят хлорид железа (III):
{[(Fe4[Fe(CN)6]3)m ∙ nFe 3+ ∙ 3(n – x) Cl ‾ ] 3+ ∙ 3xCl ‾ }.
Отметим, что в случае, когда степень окисления ионов внутренней и наружной обкладки неодинаковы, нужно в формулу поставить коэффициент, уравнивающий эти степени окисления (как, например, это сделано в формуле берлинской лазури, которую мы привели выше).
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
Из строения мицеллы следует, что у неё на границе раздела двух фаз (твёрдой и жидкой) возникает тонкий поверхностный слой из пространственно разделённых электрических зарядов противополжного знака, который и носит название двойного электрического слоя (ДЭС).
Современные представления о строении ДЭС следующие:
1. ДЭС образован потенциалопределяющими ионами, находящимися на поверхности твердой частицы и эквивалентным количеством противоионов, находящихся в дисперсионной среде вблизи поверхности твердой частицы.
2. Потенциалопределяющие ионы прочно связаны с твердой частицей и равномерно распределены по её поверхности.
3. Противоионы имеют конечные размеры и, следовательно, не могут подходить к твердой поверхности ближе, чем на расстояние одного ионного радиуса.
4. Слой противоионов, компенсирующих заряд твердой поверхности, имеет сложное строение и состоит из двух частей: плотного слоя (адсорбционного слоя или слоя Гельмгольца) и диффузного слоя (слоя Гуи).
5. Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину порядка диаметра гидратированного противоина d. Те противоионы, которые находятся в этом пространстве, называются адсорбционными противоионами. Они связаны с заряженной твердой частицей двумя видами сил – адсорбционными и электростатическим.
6. Диффузный слой имеет толщину δ, его образуют те противоины, которые находятся от заряженной поверхности на расстоянии, большем d, но в пределах расстояния δ. Эти противоины притягиваются к частице только электростатическими силами, следовательно, менее прочно, чем противоионы адсорбционного слоя. При движении твердой частицы они от неё отрываются. На противоионы диффузного слоя большое влияние оказывает тепловое движение, которое стремится распределить их равномерно по всему объему системы. Его действие тем сильнее, чем дальше от заряженной поверхности находятся противоионы. Это приводит к установлению динамического равновесия в диффузном слое. Так как противоионы в диффузном слое распределены неравномерно, то падение потенциала в нем (φδ) происходит также неравномерно – по какой-то криволинейной зависимости.
7. Полное падение потенциала ДЭС называется термодинамическим потенциалом φ0:
φ0 = φd + φδ
ЭЛЕКТРОКИНЕТИЧЕСКИЙ ПОТЕНЦИАЛ
Потенциал на плоскости скольжения называется ЭЛЕКТРОКИНЕТИЧЕСКИМ ПОТЕНЦИАЛОМ (или дзета-потенциалом).
Дзета-потенциал является одной из важнейших характнеристик ДЭС. Чем больше размыт двойной слой, тем больше и дзета-потенциал. Если слой предельно сжат, то дзета-потенциал равен 0. Это соответствует изоэлектрическому состоянию, и система не реагирует на электрический ток, тогда как φ0 – потенциал остаётся практически неизменным.
Величина дзета-потенциала определяется:
¨ Величиной термодинамического потенциала φ0 и характером падения потенциала в ДЭС;
¨ Характером движения жидкости вблизи твердой поверхности (он определяет местонахождение плоскости скольжения), который зависит, главным образом, от вязкости среды.
Дзета-потенциал выражается следующей формулой:
ζ = 
где η – вязкость среды, U0 – линейная скорость движения фаз, Е – напряженность электрического поля, ε – относительная диэлектрическая проницаемость среды, ε0 – абсолютная диэлектрическая проницаемость вакуума (или электрическая постоянная); Е – напряженность электрического поля.
Величина дзета-потенциала определяется общим содержанием электролитов в растворе; увеличение концентрации электролита влечёт за собой сокращение толщины диффузного слоя и, следовательно, сопровождается уменьшением ζ-потенциала. ζ-потенциал зависит не только от концентрации ионов, но и от их заряда. Способность понижать ζ-потенциал растет с ростом заряда противоиона.
ζ-потенциал связан с устойчивостью коллоидных систем. Устойчивость этих систем падает с понижением ζ-потенциала.
КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
Проблема устойчивости коллоидных систем – одна из важнейших проблем коллоидной химии.
Русский учёный Песков предложил рассматривать:
а) седиментационную (кинетическую) устойчивость;
б) агрегативную устойчивость.
Эти два вида устойчивости имеют разные механизмы и требуют отдельного рассмотрения.
Седиментационная устойчивость – это способность дисперсной системы сохранять неизменным во времени распределение частиц по всему объёму системы, т.е. способность системы противостоять действию силы тяжести.
Седиментационная устойчивость дисперсных систем определяется, главным образом, размерами частиц дисперсной фазы:
v Лиофобные золи (10 –7 – 10 –5 см) – седиментационно устойчивые системы, диффузия обеспечивает равномерное распределение частиц по всему объёму системы;
v микрогетерогенные системы (10 – 5 – 10 – 3 см); в них устанавливается седиментационно-диффузионное равновесие, для которого характерно распределение частиц по всему объёму системы в соответствии с теорией Гиббса;
v грубодисперсные (более 10 – 3 см) – седиментационно неустойчивы, частицы быстро выпадают в осадок.
Агрегативная устойчивость – это способность дисперсной системы сохранять во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Агрегативная устойчивость препятствует слипанию частиц и препятствует их осаждению.
Существует 5 факторов, которые могут обеспечивать агрегативную устойчивость золя: электростатический; адсорбционно-сольватный; структурно-механический; энтропийный; гидродинамический.
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся более крупными и не могут участвовать в броуновском движении.
Коагуляция самопроизвольный процесс, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но ещё не теряют своей седиментационной устойчивости.
2 стадия – явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Коагуляция возникает под действием разнообразных внешних воздействий. К ним относятся:
¨ изменение температуры;
¨ действие электрического и электромагнитного полей;
¨ действие видимого света;
¨ облучение элементарными частицами;
¨ механическое воздействие;
¨ добавление электролитов и др.
Коагуляция электролитами происходит при сравнительно невысокой концентрации добавляемого электролита. Коагуляцию вызывают все электролиты, так как при введении их в коллоидную систему происходит сжатие диффузного слоя, снижение ζ-потенциала, что и приводит к разрушению коллоидной системы. Минимальная концентрация электролита, вызывающая за данный промежуток времени определённый видимый эффект коагуляции, называется порогом коагуляции (γ) или критической концентрацией (скрит). Эта величина служит сравнительным критерием агрегативной устойчивости дисперсной системы. Критическую концентрацию принято выражать в ммоль/л.
Коагуляцию вызывает ион противополжного знака знаку заряда коллоидной частицы: для положительных – анион, для отрицательных – катион, вводимого в систему электролита. Коагулирующее действие иона тем выше, чем выше его заряд (правило Шульце-Гарди).
ТЕОРИЯ УСТОЙЧИВОСТИ ЛИОФОБНЫХ ЗОЛЕЙ – ТЕОРИЯ ДЛФО
Современная теория устойчивости, развитая российскими учёными Б.В. Дерягиным и Л.Д. Ландау, получила всеобщее признание.
Несколько позже такую же теорию создали голландские учёные Фервей и Овербек. Поэтому теорию называют теорией ДЛФО. Суть этой теории физической коагуляции в следующем.[
Когда коллоидные частицы подходят близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Устойчивость лиофобных золей определяется главным образом, особыми свойствами этих тонких жидких слоёв. Такой слой образуется при сближении коллоидных частиц.
КИНЕТИКА КОАГУЛЯЦИИ
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции V – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы.
V = - 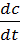 ,
,
где «c» – концентрация частиц; t – время. Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции α:
α = 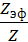 ,
,
где Z – общее число столкновений частиц в единицу времени; Zэф – число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
Если α = 0, коагуляция не происходит, золь агрегативно устойчив.
Если α = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
Если 0 ‹ α ‹ 1, то идет медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.