Группа 3ПК 2-й курс
Г 18.11.2021 г
Предмет ХИМИЯ
Тема 8: Строение атома. Строение вещества.
Урок № 35,36 ОДП.02 Химия (2 урока)
Тема урока «Ковалентная химическая связь. Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы. Молекулярные и атомные кристаллические решетки».
Цель: углубить и расширить знания о причинах возникновения ковалентной химической связи.
Развивающая цель: развивать представления о ковалентной полярной и неполярной химической связи.
Воспитательная цель: продолжить формирование интереса к предмету и химического видения мира, воспитывать самостоятельность, умение сотрудничать с учителем и другими учащимися
Задачи:
- обучающие: сформировать знания о ковалентной химической связи,
-развивающие: развитие химического языка, логического мышления;
-воспитательные: представить глобальность веществ с ковалентной связью для окружающего мира.
Тип урока: урок формирования новых знаний.
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
Различают три основных типа химической связи: ковалентную, ионную, металлическую.
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Между неметаллами.
Неоходимо ввести понятие электроотрицательность. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.

ряд электроотрицательностей
Элементы, стоящие левее, будут оттягивать общие электроны от элементов стоящих правее.
Для наглядного изображения ковалентной связи в химических формулах используются точки (каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре).
Пример. Связи в молекуле Cl2 можно изобразить так:
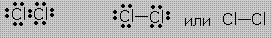
Такие записи формул равнозначны. Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решётки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
С позиции теории Бора образование ковалентной связи объясняется тенденцией атомов преобразовывать свой внешний слой в октет (полное заполнение до 8 электронов).Оба атома представляют для образования ковалентной связи по одному неспаренному электрону, и оба электрона становятся общими.
Пример. Образование молекулы хлора.
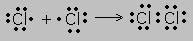
Точками обозначены электроны. При расстановке следует соблюдать правило:электроны ставятся в определённой последовательности-слева, сверху, справа, снизу по одному, затем добавляют по одному, неспаренные электроны и принимают участие в образовании связи.
Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
КРАТНОСТЬ СВЯЗИ
- число электронных пар, обобществлённых двумя соседними атомами молеку-лы в результате ковалентной химической связи. Так, в молекуле этана
Н 3 С-СН3 связь С-С одинарная, К. с. равна единице (одна общаяпара электронов); в молекуле
этилена Н 2 С = СН 2 связь С = С двойная, К. с. равна двум (две – пары обобществлённых электронов); в молекуле ацетилена НС  СН тройная связь с тремя обобществлённымипарами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связиС-С в органич. соединениях 0,154 нм, С=С - 0,133 нм и С
СН тройная связь с тремя обобществлённымипарами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связиС-С в органич. соединениях 0,154 нм, С=С - 0,133 нм и С  С - 0,121 нм. Прочность связи соответственновыше у связи С
С - 0,121 нм. Прочность связи соответственновыше у связи С  С.
С.
К. с. не всегда выражается целым числом. Так, в молекуле бензола С 6 Н 6 все связи углерод=углерододинаковы и длины их равны 0,140 нм. Считается, что К. с. С-С в молекуле бензола равна 1,5. В металлоор-ганич. и комплексных соединениях К. с. выражается дробным числом, а иногда и вовсе не поддаётсяоднозначному определению.
Атомные кристаллические решетки характерны для соединений с ковалентной типом химической связи. В узлах таких решеток находятся отдельные атомы, между которыми существует ковалентная связь. Все связи равноценны и крепкими, поэтому вещества с таким типом кристаллической решетки характеризуются большой твердостью, высокими температурами плавления, химической инертностью. Такой тип кристаллической решетки характерно для алмаза, кремний (IV) оксида, бора.
Молекулярные кристаллические решетки характерны для соединений с ковалентной типом химической связи. В узлах таких решеток находятся неполярные или полярные молекулы. Вследствие слабых сил взаимодействия вещества с таким типом кристаллической решетки имеют незначительную твердость, низкие температуры плавления и кипения, характеризуются летучестью. Такой тип кристаллической решетки характерно для кислорода, йода, воды, глюкозы, спиртов, нафталина.
Задание выполнить до 22.11. 2021 г. Прислать личным сообщением в ВК.