История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (районКутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2· x H2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля,кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
Минералы марганца
· пиролюзит MnO2· x H2O, самый распространённый минерал (содержит 63,2 % марганца);
· манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
· браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
· гаусманит (MnIIMn2III)O4;
· родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
· псиломелан m MnO • MnO2 • n H2O (45-60 % марганца);
· пурпурит Mn3+[PO4], (36,65 % марганца).
Получение
1. Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
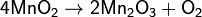
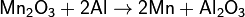
2. Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (≅80 % Mn).
3. Чистый металлический марганец получают электролизом
Физические свойства
· Работа выхода электрона: 4,1 эВ
· Коэффициент линейного температурного расширения: 0,000022 см/см/°C (при 0 °C)
· Электропроводность: 0,00695·106 Ом−1·см−1
· Теплопроводность: 0,0782 Вт/см·K
· Энтальпия атомизации: 280,3 кДж/моль при 25 °C
· Энтальпия плавления: 14,64 кДж/моль
· Энтальпия испарения: 219,7 кДж/моль
Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны).
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
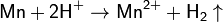
С концентрированной серной кислотой реакция идёт по уравнению:
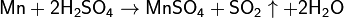
С разбавленой азотной кислотой реакция идёт по уравнению:
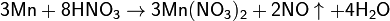
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
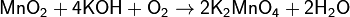
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
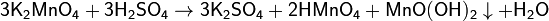
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители
Применение в промышленности
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится тверже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Техне́ций — элемент побочной подгруппы седьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 43. Обозначается символом Tc (лат. Technetium). Простое вещество технеций — радиоактивный переходный металл серебристо-серого цвета. Самый лёгкий элемент, не имеющий стабильных изотопов. Первый из синтезированных химических элементов.
Технеций был предсказан Менделеевым как эка-марганец на основе Периодического закона. Начиная с 1846 г., когда элемент был «открыт» под именем ильмений, периодически производились ошибочные «открытия» элемента 43 (как люций, ниппоний и мазурий).
C развитием ядерной физики стало понятно, почему технеций никак не удаётся обнаружить в природе: в соответствии с правилом Маттауха-Щукарева этот элемент не имеет стабильных изотопов. Технеций был синтезирован из молибденовой мишени, облучённой на ускорителе-циклотроне ядрами дейтерия, 13 июля 1937 года К.Перрье и Э.Сегре в Национальной лаборатории им. Лоуренса в Беркли в США, а затем был выделен в чистом виде химически в Палермо в Италии.
Происхождение названия
От др.-греч. τεχνητός — искусственный, отражая пионерское открытие элемента путём синтеза.
Получение
Технеций получают из радиоактивных отходов химическим способом.
Кроме того, технеций образуется при делении нуклидов 232Th, 233U, 238U, 239Pu и может накапливаться в реакторах килограммами за год.
Нахождение в природе
На Земле встречается в следовых количествах в урановых рудах, 5·10−10 г на 1 кг урана. Методами спектроскопии выявлено содержание технеция в спектрах некоторых звёзд созвездий Андромеды и Кита.
Технеций — радиоактивный переходный металл серебристо-серого цвета с гексагональной решёткой (a = 2,737 Å; с = 4,391 Å). По химическим свойствам технеций близок к марганцу и рению, в соединениях проявляет степени окисления от −1 до +7. При взаимодействии с кислородом образует оксиды Tc2O7 и TcO2, с хлором и фтором — галогениды TcX6, TcX5, TcX4, с серой — сульфиды Tc2S7 и TcS2. Технеций входит в составкоординационных и элементоорганических соединений. В ряду напряжений технеций стоит правее водорода, не реагирует с соляной, но легко растворяется в азотной и серной кислотах.
Применение
Используется в медицине для контрастного сканирования желудочно-кишечного тракта при диагностике ГЭРБ и рефлюкс-эзофагита посредством меток.
Пертехнетаты (соли технециевой кислоты HTcO4) обладают антикоррозионными свойствами, так как ион TcO4−, в отличие от ионов MnO4− и ReO4−, является самым эффективным ингибитором коррозии для железа и стали.
Ре́ний — химический элемент с атомным номером 75 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом Re (лат. Rhenium). При стандартных условиях представляет собой плотный серебристо-белый металл.
История
Существование рения было предсказано Д. И. Менделеевым («двимарганец»), по аналогии свойств элементов в группе периодической системы.
Элемент открыли в 1925 году немецкие химики Ида и Вальтер Ноддак при проведении исследований в лаборатории компании Siemens&Halske. Элемент назван в честь Рейнской провинции Германии — родины Иды Ноддак.
Рений стал последним открытым элементом, у которого известен стабильный изотоп. Все элементы, которые были открыты позднее рения (в том числе и полученные искусственно) не имели стабильных изотопов.
Геохимия рения
Рений — один из редчайших элементов земной коры. Его кларковое число — 10−3 г/т. По геохимическим свойствам он схож со своими гораздо более распространёнными соседями по периодической системе —молибденом и вольфрамом. Поэтому в виде малых примесей он входит в минералы этих элементов. Основным источником рения служат молибденовые руды некоторых месторождений, где его извлекают как попутный компонент.
Рений встречается в виде редкого минерала джезказганита (CuReS4), найденного вблизи казахстанского города Джезказган (современное название — Жезказган). Кроме того, в качестве примеси рений входит в колумбит, колчедан[7], а также в циркон и минералыредкоземельных элементов[8].
О чрезвычайной рассеянности рения говорит тот факт, что в мире известно только одно экономически выгодное месторождение рения. Оно находится в России: запасы в нём составляют около 10-15 тонн. Это месторождение было открыто в 1992 году на вулкане Кудрявый, остров Итуруп, Курильские острова[9]. Месторождение[10] в кальдере на вершине вулкана представлено фумарольным полем размерами ~50×20 м с постоянно действующими источниками высокотемпературных глубинных флюидов — фумаролами. Это означает, что месторождение активно формируется по сегодняшний день. Рений находится здесь в форме минерала рениит ReS2, со структурой, аналогичной молибдениту.
Ещё один минерал, содержащий рений, — таркианит (Cu,Fe)(Re,Mo)4S8 с 53,61 мас. % рения — был обнаружен в концентрате из месторождения Хитура в Финляндии (Kojonen еtаl., 2004).
]Физические свойства
Рений — тугоплавкий тяжёлый металл, по внешнему виду напоминает сталь. Порошок металла — чёрного или темно-серого цвета в зависимости от дисперсности. По ряду физических свойств рений приближается к тугоплавким металлам VI группы (молибден, вольфрам), а также к металлам платиновой группы. По температуре плавления рений занимает второе место среди металлов, уступая лишь вольфраму, а по плотности — четвёртое (после осмия, иридия и платины). По температуре кипения стоит на первом месте среди химических элементов (5873 К по сравнению с 5828 К у вольфрама). Чистый металл пластичен при комнатной температуре, но вследствие высокого модуля упругости после обработки твёрдость рения сильно возрастает из-за наклёпа. Для восстановления пластичности его отжигают в водороде, инертном газе или вакууме. Рений выдерживает многократные нагревы и охлаждения без потери прочности. Его прочность при температуре до 1200°C выше, чем вольфрама, и значительно превосходит прочность молибдена. Удельное электросопротивление рения в четыре раза больше, чем у вольфрама и молибдена[6].
Химические свойства
Компактный рений устойчив на воздухе при обычных температурах. При температурах выше 300°C наблюдается окисление металла, интенсивно окисление идет при температурах выше 600°C. Рений более устойчив к окислению, чем вольфрам, не реагирует непосредственно с азотом и водородом; порошок рения лишь адсорбирует водород. При нагревании рений взаимодействует с фтором, хлором и бромом. Рений почти не растворим в соляной и плавиковой кислотах и лишь слабо реагирует с серной кислотой даже при нагревании, но легко растворяется в азотной кислоте. Со ртутью рений образует амальгаму[11].
Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты.