Фармакокинетика лекарственных средств у детей
Термин «фармакокинетика» в 1953 г. предложил F. H. Dost. В первом номере журнала «Journal of Pharmacokinetics and Biopharmaceutics» было дано такое определение: «Фармакокинетика — это исследование кинетики всасывания, распределения, метаболизма и экспрессии лекарств в сопоставлении с соответствующим фармакологическим, терапевтическим или токсическим эффектом у человека и животных». Год спустя, во введении к сборнику материалов первого симпозиума по клинической фармакокинетике, дано следующее определение этой дисциплины: «Клиническая фармакокинетика — это отрасль науки о здоровье, которая использует фармакокинетические подходы для безопасного и эффективного терапевтического применения лекарств у конкретных больных».
Таким образом, оптимизация фармакотерапии невозможна без знания фармакокинетических параметров лекарственного средства (ЛС) и особенностей его фармакокинетики у конкретного больного.
Влияние возраста на распределение и циркуляцию ЛС проявляется в основном в крайних возрастных группах: с одной стороны — у новорожденных и детей 1-го года жизни, с другой — у пожилых людей старше 60 лет. У разных людей возрастные изменения фармакокинетики, так же, как и различных физиологических параметров, происходят с разной скоростью и зависят от многих средовых факторов.
Детский организм имеет ряд существенных отличий от организма взрослого человека. Именно эти отличия и особенности фармакокинетики ЛС в детском возрасте рассмотрены в данной контрольной работе.
ВСАСЫВАНИЕ
Особенности всасывания препаратов в желудочно-кишечном тракте (ЖКТ) у новорожденных детей и грудных младенцев определяются следующими факторами:
1. pH содержимого желудка в течение нескольких суток после рождения близко к нейтральному и снижается очень медленно, достигая значений 1. 1. pH желудочного сока, характерных для взрослых, после двухлетнего возраста;
2. нерегулярное и обычно медленное опорожнение желудка в течение первых шести месяцев жизни (опасность введения гиперосмолярных растворов — некротизирующий энтероколит);
3. низкая микробная обсемененность кишечника;
4. высокая активность Р-глюкуронидазы в кишечнике (повторное всасывание высвобожденного из связи с глюкуроновой кислотой неполярного, легко реабсорбирующегося исходного вещества — энтерогепатическая циркуляция);
5. ослабленная желчевыводящая функция.
В результате высоких значений pH желудка младенцев отмечается меньшее расщепление некоторых пенициллинов и их более высокая биодоступность при приеме внутрь. Наоборот, ряд препаратов, имеющих кислотные свойства (фенобарбитал, фенитоин, налидиксовая кислота и др.), более интенсивно ионизируются при нейтральном значении pH, что приводит к уменьшению их всасывания у младенцев. Разнонаправленное влияние физиологических особенностей ЖКТ новорожденных на абсорбцию ЛС приводит к тому, что одни препараты (теофиллин, эритромицин) всасываются быстрее, другие (рифампицин) — медленнее, чем у взрослых. Значительные изменения всасывания наблюдались при введении ЛС внутрь недоношенным новорожденным. Например, максимальная концентрация хлорамфеникола достигалась только через 12 часов после однократного введения препарата.
При пероральном назначении растворов следует учесть, что гиперосмолярные растворы любых веществ (в том числе сахарозы, натрия гидрокарбоната и пр.) относятся к факторам, способствующим развитию некротизирующего энтероколита. Так, сообщалось о случаях развития данного заболевания у недоношенного новорожденного после назначения ему через рот раствора кальция глюконата, добавленного к питательной смеси, введенной через назогастральный зонд.
Для предсказания возрастных особенностей всасывания ЛС в желудке необходимо учитывать, что pH в нем на высоте секреции соляной кислоты составляет у детей месячного возраста 5,8; в возрасте 3-7 месяцев — около 5; 8 - 9 месяцев — 4,5; а к 3 годам достигает значений 1,5 - 2,5, как у взрослых.
Если лекарственное вещество при значениях pH, свойственных средам организма, находится главным образом в неионизированном виде, оно лучше растворимо в липидах, чем в воде, и хорошо проникает через биологические мембраны. Если вещество ионизировано, оно плохо проникает через мембраны клеток в различные ткани и органы, но обладает лучшей водорастворимостью.
 Каждое лекарственное вещество характеризуется своим показателем рКа — значением pH, при котором в ионизированном (диссоциированном) виде находится половина введенной дозы вещества. (табл 1.)
Каждое лекарственное вещество характеризуется своим показателем рКа — значением pH, при котором в ионизированном (диссоциированном) виде находится половина введенной дозы вещества. (табл 1.)
Для того, чтобы увеличить всасывание ЛС, назначаемых перорально, а значит, и их биодоступность, необходимо руководствоваться следующими принципами:
1. лекарства — слабые кислоты — тем лучше всасываются, чем более кислой является среда в желудке, так как при этом они меньше диссоциируют; лекарства — слабые основания — наоборот, лучше всасываются из более щелочной среды, поэтому их часто рекомендуют запивать щелочными минеральными водами, которые к тому же ускоряют опорожнение желудка в двенадцатиперстную кишку;
2. наиболее кислой среда желудка бывает во время и сразу после еды, наименее кислой — за 1 час или через 1,5-2 часа после еды;
3. чем быстрее лекарственный препарат поступает в кишечник (с очень большой всасывающей поверхностью), тем скорее он всасывается, создавая большие концентрации в крови.
В связи с последним положением необходимо помнить, что характер пищи также влияет на опорожнение желудка. Так, при вскармливании грудным молоком опорожнение желудка происходит через 2-3 часа, коровьим молоком — через 3-4 часа, существенно возрастая при увеличении количества жира и белка в пище.
Всасывание через кожу у новорожденных детей и грудных младенцев протекает значительно более интенсивно, что связано с малой толщиной рогового слоя кожи и с ее увеличенной гидратацией. В результате у младенцев могут наблюдаться системные проявления при контакте с кожей некоторых препаратов для наружного применения (мази с салициловой кислотой, присыпки с борной кислотой, препараты йода, глюкокортикоиды).
При назначении ЛС путем ингаляции следует учитывать, что у детей, особенно младшего возраста, слизистая оболочка дыхательных путей легко подвергается раздражению, реагирует на него обильным отделением секрета и набуханием, что может нарушить проходимость дыхательных путей. Особенно большую осторожность нужно соблюдать при вдыхании кислорода, который вызывает не только раздражение, но и повреждение слизистых оболочек, а у недоношенных новорожденных угнетает синтез сурфактанта.
При закапывании растворов в полость носа ребенку необходима осторожность, поскольку:
· раздражающее вещество (протаргол) может вызвать рефлекторную (с поверхности глотки и верхних дыхательных путей) остановку дыхания;
· повышенная проницаемость слизистой оболочки может привести к возникновению системного эффекта (а-адреномиметики — необходима более низкая концентрация);
· жирорастворимые вещества (фентанил, кетамин, мидазолам) хорошо всасываются со слизистой оболочки носа, быстро попадая в цереброспинальную жидкость (ЦСЖ) и мозг, так как существует прямой контакт подслизистой оболочки носа с субарахноидальным пространством обонятельной доли мозга.
Всасывание после внутримышечного (в/м) введения у младенцев отличается от такового у взрослых под влиянием ряда факторов, основные из которых:
· периферическая вазомоторная нестабильность
· изменчивость кровоснабжения различных мышц
· низкая активность мышечных сокращений
· малая относительная масса скелетных мышц и подкожного жира
· высокий процент воды в мышцах.
Часть этих факторов может ускорять всасывание после в/м введения, а другая часть — наоборот, замедлять. В результате для различных препаратов по-разному изменяется скорость всасывания из мышц младенцев по сравнению со взрослыми. Судя по времени достижения максимальной концентрации после однократного в/м введения, фенобарбитал, канамицин и амикацин всасываются у новорожденных быстрее; а диазепам — примерно с такой же скоростью, как у взрослых. Особенно резко снижается всасывание некоторых препаратов из мышц недоношенных новорожденных: максимум концентрации пенициллина В наблюдается через 4-6 часов после введения (при массе тела недоношенного новорожденного менее 2 кг), тогда как у детей первых месяцев жизни после срочных родов — через 0,5 часа. Скорость всасывания многих ЛС, в частности антибиотиков, у новорожденных заметно меньше, чем у детей месячного возраста, у которых она примерно сопоставима с этим показателем у взрослых.
Из-за нестабильности гемодинамики у новорожденных детей, особенно при токсикозах, обезвоживании, нарушениях дыхания и сердечно-сосудистой деятельности, вещество может задержаться на месте введения, создавая в нем депо. Необходимо отметить, что повторные в/м инъекции не ускоряют всасывание, более того, они могут привести, после восстановления гемодинамики, к высокой концентрации ЛС в плазме крови, способной вызвать чрезмерный, даже токсический эффект. Поэтому при коматозном состоянии, обезвоживании, нарушении сердечно-сосудистой деятельности необходимо избегать в/м введения, вещество должно вводиться только внутривенно (в/в).
Некротизирующий энтероколит может развиться не только при введении гиперосмолярных растворов per os, но и при введении их в/в. В связи с этим нельзя использовать 10 %-ные и более концентрированные растворы глюкозы для разведения веществ, вводимых в/в. Не следует использовать в качестве растворителя и многокомпонентные растворы; следует предпочитать изотонический раствор натрия хлорида, так как почки новорожденных детей еще не способны быстро удалять различные ионы, что может привести к задержке ионов и воды, к развитию дисионии.
РАСПРЕДЕЛЕНИЕ И СВЯЗЫВАНИЕ С БЕЛКАМИ И ФОРМЕННЫМИ ЭЛЕМЕНТАМИ
У новорожденного ребенка и грудного младенца относительное содержание воды в организме выше, а отношение количества внутриклеточной и внеклеточной воды — ниже, чем у взрослых. Поэтому вещества, хорошо растворимые в воде (строфантин), оказавшись в большем ее объеме, создают у детей меньшую концентрацию в плазме. Жировой ткани у младенцев относительно меньше (15 % массы тела), меньше и масса скелетных мышц (25 % массы тела). В результате в плазме крови новорожденных отмечается большая концентрация липидорастворимых препаратов. Ярким примером этому служит дигоксин, концентрация которого после введения равной дозы на единицу массы тела в плазме крови новорожденных младенцев больше, чем у старших детей и взрослых. В то же время относительная масса мозга и печени у новорожденных и грудных детей значительно ниже, чем у взрослых. Эти анатомические особенности могут значительно сказаться на распределении лекарств в первые дни и месяцы после рождения. У новорожденных младенцев отличаются и некоторые физиологические параметры, влияющие на распределение препаратов: pH крови, параметры КЩС и гемодинамики.
Распределение препаратов у новорожденных детей может существенно зависеть от массы тела ребенка при рождении — у детей 2,5 кг и ниже увеличивается проницаемость гематоэнцефалического барьера (ГЭБ), снижается скорость элими нации и растет уровень препарата в крови по сравнению с новорожденными с массой тела около 3 кг (тобрамицин).
 У новорожденных и грудных детей отмечается недостаточная зрелость гистогематических барьеров. Наибольшее значение имеет незрелый ГЭБ, через который ЛС поступают в большем количестве в мозг, создавая в нем более высокие концентрации, чем у взрослых. Это необходимо учитывать при назначении препаратов как центрального (особенно угнетающих центральную нервную систему), так и периферического действия. Например, осмотически активные вещества у новорожденных и грудных детей легко проникают в мозг и препятствуют созданию осмотического градиента между плазмой крови и ЦСЖ, что затрудняет выведение воды из мозговой ткани при отеке мозга. К тому же назначение осмотически активных растворов повреждает ГЭБ (происходит его «раскрытие»), что облегчает попадание в мозг других экзогенных и эндогенных (например, билирубин) веществ.
У новорожденных и грудных детей отмечается недостаточная зрелость гистогематических барьеров. Наибольшее значение имеет незрелый ГЭБ, через который ЛС поступают в большем количестве в мозг, создавая в нем более высокие концентрации, чем у взрослых. Это необходимо учитывать при назначении препаратов как центрального (особенно угнетающих центральную нервную систему), так и периферического действия. Например, осмотически активные вещества у новорожденных и грудных детей легко проникают в мозг и препятствуют созданию осмотического градиента между плазмой крови и ЦСЖ, что затрудняет выведение воды из мозговой ткани при отеке мозга. К тому же назначение осмотически активных растворов повреждает ГЭБ (происходит его «раскрытие»), что облегчает попадание в мозг других экзогенных и эндогенных (например, билирубин) веществ.
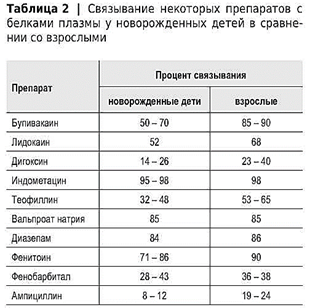
У детей грудного возраста, как правило, снижено связывание с белками большинства ЛС (табл. 2).
Это обусловлено уменьшением содержания общего белка в плазме крови и изменением соотношения плазменных белков — более низким количеством γ-глобулинов и липопротеинов. У новорожденных детей, как и у плода, альбумины в течение долгого времени обладают пониженной способностью связывать молекулы ЛС. Это объясняется следующими факторами:
· в плазме крови новорожденных меньше содержание белков вообще и альбуминов в частности;
· в плазме крови у них содержится фетальный альбумин, который количественно и качественно иначе связывает вещества по сравнению с альбумином крови взрослых;
· на первой неделе жизни у младенцев отмечается увеличение липолиза и в связи с этим повышение уровня свободных жирных кислот в сыворотке крови, препятствующих связыванию с белками многих веществ.
Связывание с белками кислотных препаратов снижено у младенцев еще и вследствие высокого содержания в плазме крови некоторых эндогенных веществ, конкурирующих с препаратами за места связывания в молекулах белков; к таким веществам прежде всего относятся свободные жирные кислоты и неконъюгированный билирубин. Причем вытеснение билирубина из мест связывания с белками под действием некоторых препаратов может привести к образованию в мозге новорожденного токсических уровней свободного билирубина. Более низкое значение pH крови, часто наблюдаемое у младенцев, может привести к изменению недиссоциированной части препарата и повлиять тем самым на распределение и связывание препаратов, особенно тех, которые имеют значение pKa, близкое к pH крови; к таким, например, относится фенобарбитал.
Связывание ЛС с белками остается на сравнительно низком уровне у детей в течение нескольких лет. Связывание кислотных препаратов достигает у детей уровня, характерного для взрослых, к 2 - 3 годам. Препараты, связывающиеся в значительной степени с γ-глобулином, только к 7 - 12 годам жизни детей имеют показатели связывания, аналогичные таковым у взрослых. Уменьшенное связывание имипрамина наблюдается у детей вплоть до 10 лет.
У детей любого возраста связывание ЛС с белками плазмы снижается при гипотрофии, заболеваниях печени (снижение синтеза белка), почек (потеря его с мочой).
Лекарства могут связываться с мембранами форменных элементов крови и проникать в них. Окисляющие вещества при этом способны вызвать гемолиз (при недостатке фермента Г6ФДГ), а попав в эритроцит — привести к образованию метгемогло- бина, что нарушит доставку кислорода к тканям. Особое значение это имеет для новорожденных младенцев, в эритроцитах которых присутствует фетальный гемоглобин, поскольку содержащееся в нем железо легко окисляется до трехвалентного, а восстанавливающих ферментов недостаточно. Гемолиз и метгемоглобинемию могут вызвать парацетамол, викасол, метиленовый синий, нитриты, а у недоношенных новорожденных детей — даже аскорбиновая кислота (вернее, ее метаболит — монодегидроаскорбиновая кислота, для восстановления которой обратно в аскорбиновую у них не хватает глутатиона).
БИОТРАНСФОРМАЦИЯ
Ферментативный гидролиз сложных эфиров происходит в организме при участии эстераз. Эстеразная активность у новорожденных детей, особенно у недоношенных, значительно ниже, чем у взрослых. Это относится к различным эстеразам: ацети- холинэстеразе, арилэстеразе, псевдохолинэстеразе и др. Активность данных ферментов постепенно возрастает до уровня взрослого человека в течение первых 12 месяцев жизни ребенка. Сниженная у новорожденных детей скорость гидролиза прокаина и других анестетиков со сложноэфирной связью может стать причиной снижения у них сердечной и дыхательной активности в случае введения этих ЛС роженице.
Активность окислительных ферментов печени у новорожденных детей снижена. Скорость окисления с участием цитохрома P-450 составляет у них примерно 50 % скорости этого процесса у взрослых, также примерно в 2 раза снижена активность НАДФН-цитохром C редуктазы. Активность упомянутых ферментов, а также анилингидроксилазы возрастает у детей с возрастом. Однако это увеличение для разных субстратов может проходить с различными скоростями, что приводит к получению противоречивых данных при сравнительном исследовании скоростей биотрансформации различных ЛС у детей первых месяцев жизни. Например, препараты из группы диметилксантинов практически не дезалкилируются, а этилморфин подвергается окислительному дезалкилированию. В печени новорожденных детей, как и у плода, один из диметилксантинов — теофиллин не только не деметилируется, а наоборот, подвергается метилированию, превращаясь в триметилксантин — кофеин. Курсовое лечение теофиллином может вызвать у младенцев нежелательные психостимулирующие и гемодинамические сдвиги.
Малая скорость биотрансформации лекарств приводит к экскреции с мочой значительных количеств препаратов, которые у взрослых обычно элиминируются путем метаболизма. Так, кофеин у взрослых экскретируется почками в неизмененном виде в очень малой степени — около 2 % от дозы, остальная часть превращается в различные метаболиты, в то же время у новорожденных с мочой выделяется 85 % исходного препарата. Деметилирование кофеина ускоряется с возрастом и достигает скорости, сравнимой с таковой у взрослых, примерно к 8 месяцам. Кроме того, следует иметь в виду возможность индукции ферментов во время внутриутробного развития за счет воздействия препаратов, принимаемых беременной женщиной. Причем эффекты индукции у новорожденных детей более выражены и сохраняются дольше, чем у взрослых.
Снижение скорости гидроксилирования у них отмечено для лидокаина, фенитоина, фенобарби тала и др. В то же время скорость окислительного дезалкилирования у новорожденных одних препаратов (диазепам, лидокаин) такая же, как у взрослых, а других (теофиллин, кофеин) — значительно снижена. Ослабленная интенсивность биотрансформации наблюдается у младенцев не только вследствие уменьшенной ферментативной активности, но и как результат менее интенсивного захвата препаратов печенью.
Реакции конъюгации с сульфатом и глицином протекают у новорожденных с интенсивностью, близкой к таковой у взрослых. Однако глюкуро- низация у детей значительно снижена и достигает уровня взрослых после 3-летнего возраста (хло- рамфеникол). В то же время в возрасте 3-5 лет биотрансформация отдельных ЛС в связи с активизацией биосинтетических процессов в растущем организме ребенка может проходит даже быстрее, чем у взрослых.
ЭКСКРЕЦИЯ С МОЧОЙ
Несмотря на то, что отношение массы почки у новорожденного к массе его тела в 2 раза выше, чем у взрослого, все функции почек при рождении значительно снижены и экскреция большинства ЛС с мочой происходит медленнее, чем у взрослых. Особенно на низком уровне находится канальцевая секреция (например, пенициллина), в то время как клубочковая фильтрация более развита. Однако в связи с тем, что висцеральный листок капсулы почечного клубочка (капсулы Шумлянского - Боумена) выстлан высоким цилиндрическим эпителием, а не низким плоским, как у взрослых, процесс фильтрации затруднен. Кроме того, у новорожденных детей всего 5 - 8 % (вместо 15-25 % у взрослых) минутного объема крови попадает в почки. Этот дисбаланс наблюдается вплоть до шестимесячного возраста. Скорость клубочковой фильтрации у ребенка сразу после срочных родов составляет примерно 1 мл/мин/кг, у недоношенных — 0,5 мл/мин/кг, для сравнения у взрослых она равна 1,7 мл/мин/кг. Снижена у новорожденных и способность к реабсорбции лекарств, что в принципе может привести к ускорению экскреции препаратов с высокой долей реабсорбции. Сниженная функция почек определяется у детей с низким почечным кровотоком, незрелостью механизмов активного транспорта, низкой относительной долей рабочих клеток. Все это особенно сильно отражается на фармакокинетике тех ЛС, которые элиминируют в основном за счет почечной экскреции.

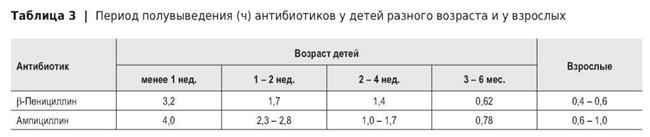
В результате снижения метаболизма и экскреции с мочой периоды полуэлиминации большинства лекарств у новорожденных оказываются в несколько раз больше, чем у взрослых (табл. 3 и 4). Это может иметь разное значение для эффективности ЛС в зависимости от места его действия. Если оно оказывает влияние на внепочечные ткани, то длительно сохраняющаяся в крови эффективная концентрация вещества может способствовать возникновению чрезмерного и даже токсического эффекта. Если вещество воздействует на почки, то медленное накопление его в почечной ткани задерживает развитие диуретического эффекта, и сам эффект может быть слабее. Примером служат замедленное развитие и большая длительность мочегонного эффекта фуросемида у новорожденных.
Из сказанного следует, что вещества, преимущественно элиминирующиеся путем почечной экскреции, у новорожденных выводятся медленнее, чем у взрослых, поэтому их надо вводить реже.
К лекарственным средствам, выводящимся преимущественно почками, относятся: ампициллин, карбенициллин, цефазолин, гентамицин, кана- мицин, ванкомицин, тобрамицин, дигоксин, метотрексат.
Особенно замедлено выведение лекарств почками в первые 7-10 дней жизни. Но здесь следует подчеркнуть, что даже на протяжении первого месяца жизни скорость выведения разных веществ увеличивается неодинаково.
Необходимо отметить интересную закономерность выведения с мочой лекарств со свойствами слабых кислот у новорожденных и грудных детей. Во время сна, длительность которого в данной группе детей наибольшая, pH мочи ниже, чем во время бодрствования. Поэтому упомянутые препараты меньше диссоциируют в моче и легче ре- абсорбируются, что приводит к уменьшению их экскреции. Лекарства со свойствами слабых оснований, наоборот, выводятся у детей первого года жизни лучше, чем у более старших.
В связи с тем, что клубочковая фильтрация у грудных детей значительно снижена, а клиренс эндогенного креатинина практически равен показателю клубочковой фильтрации, показатель клиренса креатинина можно использовать для корректировки режима дозирования ЛС.
Клиренс креатинина можно рассчитать, исходя из его содержания в плазме крови данного больного. Для детей существует следующая эмпирическая формула расчета клиренса эндогенного креатинина (формула Шварца):
 ,
,
где K — возрастной коэффициент пересчета:
0,33 — недоношенные новорожденные младенцы в возрасте до 2 лет;
0,45 — доношенные новорожденные младенцы в возрасте до 2 лет;
0,55 — дети в возрасте 2-14 лет;
0,55 — девочки старше 14 лет;
0,70 — мальчики старше 14 лет.
Поскольку все больше рождается недоношенных новорожденных с очень низкой массой тела, следует напомнить несколько особенностей выделительной функции их почек. Они заключаются не только в очень небольшой скорости клубочковой фильтрации и неэффективности канальцевой реабсорбции. Это существенно сказывается на содержании и выведении натрия из организма. Экскреция его в первые дни очень высока. Вследствие интенсивной экскреции натрия повышается выведение воды, снижается объем внеклеточной жидкости, что отражается на фармакокинетике водорастворимых ЛС и приводит к созданию более высоких их концентраций как в плазме крови, так и во внеклеточной жидкости. Введение больших количеств жидкости таким детям сопровождается необычной реакцией, характеризующейся в отличие от доношенных новорожденных детей задержкой воды в организме несмотря на увеличение скорости клубочковой фильтрации и клиренса свободной воды. У доношенных новорожденных детей обычно выведение мочи после обильного введения жидкости может быть даже больше объема введенной жидкости. Задержка жидкости у недоношенных новорожденных детей может привести к увеличению частоты случаев открытия артериального протока, некротизирующего энтероколита, бронхопульмональной дисплазии.
Таким образом, изменения почти всех фармакокинетических параметров у новорожденных и детей первых месяцев жизни требуют особого подхода при назначении ЛС в этом возрасте. Большое значение для объективизации назначений имеют фармакокинетические исследования, которые в неонатологии интенсивно проводятся только последние 15-20 лет. Однако большая индивидуальная вариабельность фармакокинетики у младенцев, связанная с особенностями внутриутробного и перинатального развития, а также с различными патологическими состояниями (асфиксия, сердечная недостаточность, заболевания ЖКТ и т.д.), не дают возможности разработать однозначные рекомендации для дозирования лекарств в первые дни и месяцы после рождения. При проведении фармакотерапии у новорожденных и грудных детей с использованием многих препаратов (теофиллин, кофеин, фенобарбитал, фенитоин, аминогликозидные антибиотики, хлорамфеникол, дигоксин и др.) необходим строгий мониторинг их концентрации в крови.
ЛИТЕРАТУРА
1. Белоусов Ю. Б. Клиническая фармакология и фармакотерапия (3-е изд.). М.: МИА, 2010.
2. Маркова И. В., Шабалов Н. П. Клиническая фармакология новорожденных. СПб.: Сотис, 1993.
3. Клиническая фармакология: национальное руководство. Под ред. Ю. Б. Белоусова, В. Г. Кукеса, В. К. Лепахина, В. И. Петрова. М.: ГЭО- ТАР-Медиа, 2009. — 976 с.
4. Клиническая фармакология по Гудману и Гилману. Под общ. ред. А. Г. Гилмана. М.: Практика, 2006. — 1648 с.
5. Белоусов Ю. Б., Гуревич К. Г. Общая и частная клиническая фармакокинетика. М.: Ремедиум, 2006.