Существует два способа экстракции тория из монацитовых руд: кислотный и щелочной. При действии на минерал сильной кислоты происходит превращение фосфат-ионов в H2PO4- и H3PO4, благодаря чему ионы металла переводятся в соли, растворимые в воде. При действии сильных щелочей нерастворимые фосфаты превращаются в нерастворимые гидроксиды металлов, которые легко растворяются в кислоте после их предварительного отделения от маточного раствора, содержащего фосфаты щелочных металлов.
И при кислотной, и при щелочной обработке торий, содержащийся в монаците, следует за редкими землями. В растворах концентрированной серно кислоты торий можно отделить от редких земель путём разбавления раствора или путём снижения его кислотности при добавлении аммиака до pH = -1; при этом выпадает в осадок гидратированный фосфат тория, захватывающий небольшое количество редкоземельных элементов. Неочищенный осадок фосфата тория с целью удаления нежелательных сульфат- и фосфат ионов обрабатывают щёлочью; образующийся осадок гидроксида тория растворяют в азотной кислоте для последующей очистки. Эффективная очистка достигается экстракцией тория трибутилфосфатом в керосине. В этом процессе нитрат тория отделяется от редких земель и других неэкстрагируемых соединений.
Торий также можно выделять в виде побочного продукта при переработке уранинита или ураноторианита с целью получения урана. Торий, остающийся в сернокислом растворе после удаления урана, экстрагируют с помощью длинноцепочечных алкиламинов в керосине. Торий образует анионный комплекс с сульфат-ионами, который в виде соединения с протонированным амином в катионной форме переходит в органическую фазу. При нейтрализации четвертичной аммониевой соли торий из органической фазы переходит в осадок или реэкстрагируется в водную фазу.
Оксидные соединения тория.
Нитраты тория.
Наиболее высокие концентрации иона тория в водном растворе могут быть достигнуты в виде нитрата. Нитрат тория можно получить растворением гидроксида тория в азотной кислоте. При испарении раствора над серной кислотой образуются гидратированные кристаллы нитрата тория. В интервале концентраций азотной кислоты 1-54% равновесная твердая фаза имеет состав Th(NO3)4×5H2O[2]; при концентрации кислоты 54-75% - Th(NO3)4×4H2O[2], а при еще более высокой кислотности, возможно, Th(NO3)4×2N2O5[2-6]. Из последнего можно получить безводный Th(NO3)4 путем откачки в высоком вакууме, но получаемое соединение не устойчиво, так как открытом виде оно быстро поглощает воду и другие донорные молекулы и не исключена возможность взаимодействия с ними.
Если кристаллизация проводится из растворов при концентрации азотной кислоты меньше 1%, например, из воды, то образуются весьма похожие кристаллы, но, как правило, непрозрачные. Данные химического анализа соответствуют составу гексагидрата нитрата тория [7, 8], однако материальный баланс по результатам химического анализа дает отклонение от 100%, т.е. соединение, несомненно, включает частично гидролизованный нитрат тория.
Нитрат тория не только очень хорошо растворим в воде, но также хорошо растворим в большом числе кислородсодержащих органических растворителей, таких, как спирты, кетоны, простые и сложные эфиры [13-18]. Известен твердый сольват Th(NO3)4·3H2O·3C2H5OCH2CH2OC2H5, кристаллизующийся из раствора нитрата тория в диэтилацэтиленгликоле, и соединения с различными азотистыми основаниями вместо кристаллизационной воды [5]. Нитрат тория можно экстрагировать из водного раствора несмешивающимся с водой органическим растворителем при условии, что его концентрация в водной фазе чрезвычайно велика или же водная фаза содержит высокую концентрацию нитрата аммония [9,10, 15, 16]. Поскольку редкоземельные металлы почти не экстрагируются в подобных условиях и остаются полностью в водной фазе, данный процесс применяется в промышленности при получении чистых солей тория из руд, содержащих редкие земли.
Тетрагидрат нитрата тория кристаллизуется в моноклинной сингонии. Соединение обладает каркасной структурой, построенной из координационных полиэдров атома тория, представляющих собой икосаэдры, в состав которых входят четыре атома кислорода молекул воды и восемь атомов кислорода нитратных групп, бидентантно координированных на атом тория.

Рис.6 Кристаллическая структура Th(NO3)4·4H2O.

Пентагидрат, кристаллизующийся из азотнокислого раствора, образуется в виде больших прозрачных кристаллов правильной формы. При низкотемпературных термодинамических измерениях Th(NO3)4·5H2O никаких особенностей не обнаружено [6,15]. Это соединение кристаллизуется в орторомбической сингонии и имеет каркасную структуру. На атоме тория хелатно координируются четыре нитратные группы и три атома кислорода молекул воды, две оставшихся молекулы воды, входят во внешнюю координационную сферу атома тория.
Рис.7 Кристаллическая структура Th(NO3)4·5H2O.
Частично гидролизованная двуядерная твердая фаза Th2(OH)2(NO3)6(H2O)8, полученная из раствора нитрата тория относится к моноклинной сингонии. Атом тория имеет КЧ=10, четыре атома кислорода его окружения принадлежат бидентантно координированным нитратным группам, остальные шесть – гидроксильным группам и молекулам воды.
При термическом разложении гидратов нитрата тория образуется ThO2, что было установлено методами ТГА и ДТА [14].
Нитрат тория образует двойные соли с нитратами почти всех однозарядных катионов, за исключением, по-видимому, нитратов лития, натрия, таллия и серебра. Соединения вида MI2Th(NO3)6 (где M=NH4, K, Rb, Cs) не содержат кристаллизационной воды и аналогичны соответствующим соединениям церия.
Наряду с соединением K3Th(NO3)7, известен также кислый нитрат K3H3Th(NO3)10·H2O; при нагревании он теряет кислоту и воду и превращается в K3Th(NO3)7.
С двухвалентными элементами торий образует двойные нитраты состава MII(NO3)2Th(NO3)4·8H2O (MII – Mg, Mn, Co, Ni, Zn).
Синтез двойных нитратов тория проводят выпариванием водного раствора нитрата тория и нитрата соответствующего металла или аммония, взятых в стехиометрическом соотношении.
Гексанитратоторат аммония кристаллизуется в моноклинной сингонии. Согласно структурным данным основой структуры (NH4)2Th(NO3)6 является торий-анионный комплекс состава [Th(NO3)6]2-. Координационный полиэдр атома тория представляет собой икосаэдр, построенный из двенадцати атомов кислорода, взятых из нитратных групп, которые бидентатно координированы на атом тория. Комплексы связаны между собой катионами аммония, которые формируют координационные полиэдры в виде искаженных одношапочных октаэдров, образующих димеры по общему ребру состава MI2O12. Катионы аммония связаны с гексанитратоторатными комплексами посредством водородных связей.

Другие двойные нитраты тория с одновалентными катионами изоструктурны рассмотренному соединению. Очевидно, данная структура благодаря своему рыхлому строению способна вмещать весьма крупные катионы вплоть до органических радикалов, т.к. в [17] упоминается соединение (C12H28N)2Th(NO3)6.
Рис.8 Кристаллическая структура (NH4)2Th(NO3)6.
Соединение MgTh(NO3)6∙8H2O относится к моноклинной сингонии: пространственная группа P21/c. Детальное исследование строения [23] позволило прийти к выводу, что формулу правильнее записывать следующим образом: [Mg(H2O)6][Th(NO3)6]·2H2O. Основу структуры составляют гесанитратоторатные комплексы аналогичные комплексам в производных однозарядных катионов. Атомы магния формируют координационный полиэдр в виде октаэдра, образованного шестью молекулами воды, ещё две молекулы воды входят во вторую координационную сферу катиона двухвалентного металла. Остальные двойные нитраты тория с 
двухвалентными элементами изоструктурны соединению магния.
Рис.9 Кристаллическая структура MgTh(NO3)6·8H2O.
Можно отметить, что для тория наиболее характерным полиэдром в системе Mk2/kO – N2O5 – ThO2 – H2O является икосаэдр (КЧ=12), другие координационные числа встречаются гораздо реже.
Ряд органических молекул-доноров образуют соединения с нитратом тория, причем возможно включение воды (кристаллогидраты). Так, соединения с бутиламином, диметиламином и триэтиламином обычно содержат воду. Соединения с ароматическими амин-N-оксидами (пиридин-, лютидин-, коллидин-, 2- или 4-пиколин- и хинолин-N-оксидами), полученные из спиртовых или ацетоновых сред, не содержат ни органического растворителя, ни воды. При изучении кристаллографических характеристик соединений с триметилфосфиноксидом Th(NO3)4·8/3(Me3PO) получены очень важные результаты. Эта структура содержит катион [Th(NO3)3(Me3PO)]+ и анион [Th(NO3)6]2-. На примере этого соединения можно проследить общую тенденцию, свойственную сольватам тория: эти соединения одновременно проявляют катионный характер и свойства, характерные для анионных комплексов. Аналогами в этом отношении являются галогенидные комплексы Co2+, Ni2+ и других ионов переходных металлов.
Фосфаты тория.
В системе ThO2 – P2O5 [16] в дополнение к нормальному фосфату тория Th3(PO4)4 обнаружено две кристаллические формы пирофосфата тория ThP2O7, «торилфосфат» (ThO)3(PO4)2 или Th3P2O11, и, возможно, метафосфат тория Th(PO3)4. Фосфаты тория имеют очень низкую растворимость в воде и с трудом растворяются в сильных кислотах, поэтому их можно осаждать из кислого раствора. Ортофосфат тория осаждается из кислого раствора в виде желатинообразного осадка, который можно перевести в кристаллическую форму путём длительного нагревания. Считается, что фосфаты Th(HPO4)2·H2O и Th(HPO4)(H2PO4)2·2H2O образуются в пропорциях, определяемых концентрацией кислоты в равновесном растворе. Принято считать, что кристаллический фосфат имеет состав Th3(PO4)4·4H2O, хотя также упоминается о более водном гидрате. Пирофосфат тория также осаждается в гидратированной форме.
Очевидно, частица Th2(PO4)3- очень устойчива; по этой причине известен целый ряд соединений MITh2(PO4)3, где MI = Li, Na, K, Rb, Cs, Cu, Ag и Tl. Большой интерес к этим соединениям обусловлен их ферроэлектрическими свойствами. Описаны соли типа MTh(PO4)2 с щелочноземельными металлами и соответствующие им соединения с двумя катионами калия или натрия, а также гидратированная диаммонийная соль. По-видимому, существуют более сложные торофосфаты, так же как и фосфаты, содержащие другие анионы. В двойных фосфатах тория со щелочными металлами при подходящих условиях два гидроксильных иона могут замещаться фосфатной группой, могут быть также получены кислые фосфаты (гидрофосфаты) и даже нейтральные фосфаты, содержащие наряду с фосфатом также анионы других кислот. Известны двойные соли пирофосфата в кристаллической форме.
Ванадаты тория.
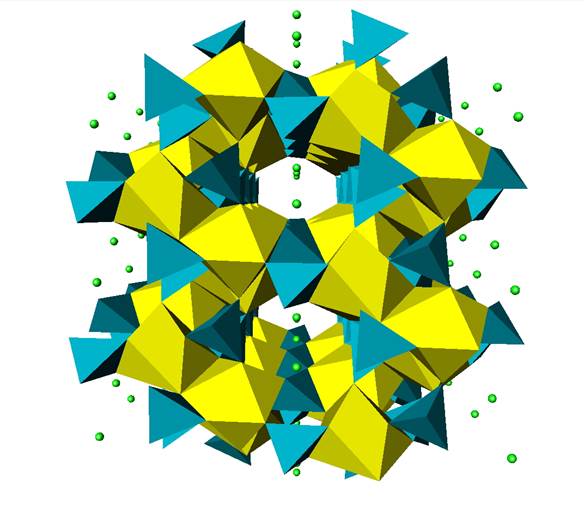 Представленная в литературе информация о ванадатах тория малочисленна. Синтезирован пированадат тория ThV2O7 и ванадат тория Th3(VO4)4. Из сложных солеподобных соединений расшифрована структура KTh2(VO4)3 [17]. Данное соединение кристаллизуется в моноклинной сингонии (пространственная группа С12/с1).
Представленная в литературе информация о ванадатах тория малочисленна. Синтезирован пированадат тория ThV2O7 и ванадат тория Th3(VO4)4. Из сложных солеподобных соединений расшифрована структура KTh2(VO4)3 [17]. Данное соединение кристаллизуется в моноклинной сингонии (пространственная группа С12/с1).
Рис. 10. Кристаллическая структура соединения KTh2(VO4)3.
Триванадатдиторат калия имеет каркасное строение. Структура представляет собой бесконечные параллельные каналы, образованные тетраэдрами ванадия и координационными полиэдрами тория. Внутри каналов в шахматном порядке расположены атомы калия.
Торий в организме.
Торий постоянно присутствует в тканях растений и животных. Коэффициент накопления тория (т. е. отношение его концентрации в организме к концентрации в окружающей среде) в морском планктоне - 1250, в донных водорослях - 10, в мягких тканях беспозвоночных - 50-300, рыб - 100. В пресноводных моллюсках (Unio mancus) его концентрация колеблется от 3·10-7 до 1·10-5 %, в морских животных от 3·10-7 до 3·10-6%. Торий поглощается в основном печенью и селезенкой, а также костным мозгом, лимфатическими железами и надпочечниками; плохо всасывается из желудочно-кишечного тракта. У человека суточное поступление тория с продуктами питания и водой составляет 3 мкг. Торий - малотоксичен, однако, как природный радиоактивный элемент вносит свой вклад в естественный фон облучения организмов.