1. Количество вещества (размерность — моль): n(x) = 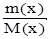 , где m(x) — масса вещества х (г), М (х) — молекулярная масса вещества х (г/моль).
, где m(x) — масса вещества х (г), М (х) — молекулярная масса вещества х (г/моль).
а) для газов: n(х) =  , где V (x) — объем газа x в л, Vm — молярный объем газов, который при нормальных условиях составляет 22,4 л/моль;
, где V (x) — объем газа x в л, Vm — молярный объем газов, который при нормальных условиях составляет 22,4 л/моль;
б) нормальные условия: Т = 273 К = 0 °С, Р = 101 кПа = 760 мм рт. ст. = 1 атм. В системе СИ для измерения давления используется величина Па;
в) количество атомов, молекул или ионов вещества х:
N(x) = NA × n(х),
где NA — число Авогадро, равное 6,02 × 1023.
2. Массовая доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
w(x) =  =
=  .
.
3. Массовая доля элемента в соединении:
w(Э) = n ×  ,
,
где n — число атомов элемента, массовая доля которого определяется в соединении.
4. Объемная доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
j(x) =  .
.
Для газов j(x) =  , где x, y... — компоненты газовой смеси; j(O2) = 21 % (в воздухе).
, где x, y... — компоненты газовой смеси; j(O2) = 21 % (в воздухе).
5. Молярная доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
c(х) =  ,
,
где x, y, z — компоненты смеси.
6. Молярная концентрация вещества х (размерность — моль/л, иногда обозначается — М): С(х) =  .
.
7. Плотность вещества х (размерность г/мл = г/см3):
r(х) =  .
.
8. Плотность газа х по газу y (безразмерная величина):
Dy (x) =  ,
,
где M(x) и M(y) — молекулярные массы газов x и y (молекулярная масса воздуха 29 г/моль).
9. Универсальный газовый закон: P1 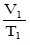 = P2
= P2  . Этот закон выполняется при неизменной массе газовой смеси.
. Этот закон выполняется при неизменной массе газовой смеси.
10. Закон Менделеева — Клайперона: P × V = n × RT = m × R ×  , где R — универсальная газовая постоянная, равная 8,314 Дж/моль × К в системе СИ.
, где R — универсальная газовая постоянная, равная 8,314 Дж/моль × К в системе СИ.
11. Растворимость вещества (х) определяется количеством граммов данного вещества, которое может раствориться в 100 г воды при заданной температуре (размерность — г; всегда указывается, при какой температуре измерена): Рt(x) =  , где w — массовая доля насыщенного раствора при данной температуре.
, где w — массовая доля насыщенного раствора при данной температуре.
|
|
12. Выход продукта реакции показывает, во сколько раз меньше получилось практического продукта реакции по сравнению с вычисленным теоретически по уравнению реакции (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах): w(х) =  =
=  =
=  . Последнее соотношение — для газов.
. Последнее соотношение — для газов.
13. Закон Гесса: тепловой эффект реакции не зависит от промежуточных стадий, а зависит лишь от начального и конечного состояний системы. Отсюда вытекает практическое следствие: тепловой эффект реакции равен разности между суммой теплот образования конечных продуктов и суммой теплот образования исходных веществ с учетом коэффициентов при формулах этих веществ в уравнениях реакции.
14. Число частиц в заданном количестве вещества х: N(x) = n × NA, NA = 6,02 × 1023.
15. Закон действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам. Для реакции типа aA + bB = dD, где a, b, d — стехиометрические коэффициенты (коэффициенты реакции), u = k × Ca(A) × Cb(B), где k — константа скорости химической реакции, равна скорости реакции при концентрациях реагирующих веществ, равных одному молю.
16. Константа равновесия реакции aA + bB Û dD + eE вычисляется по формуле: K(равновесия) =  , где С — молярная концентрация веществ в равновесном состоянии.
, где С — молярная концентрация веществ в равновесном состоянии.
|
|
17. Закон Вант — Гоффа: при увеличении температуры на каждые 10 градусов скорость реакции возрастает в 2—4 раза.  =
= 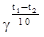 , где g — температурный коэффициент Вант — Гоффа, который колеблется для разных реакций от 2 до 4.
, где g — температурный коэффициент Вант — Гоффа, который колеблется для разных реакций от 2 до 4.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная
1. Фельдман Ф. Г., Рудзитис Г. Е. Химия: учебники с 8-го по 11-й класс средней школы. М.: Просвещение. 2004—2009.
2. Цветков Л. А. Органическая химия: Учебник для 10-го класса средней школы. М.: Просвещение, 2004—2009.
3. Химия: Справочные материалы / под ред. Ю. Д. Третьякова. М.: Просвещение, 1984—1998.
Дополнительная
1. Хомченко Г. П. Химия для поступающих в вузы. М.: Высш. шк., 1988—2002.
2. Ахметов Н. С. Неорганическая химия: в 2 ч. 3-е изд. М.: Просвещение. 1992.
3. Хомченко Г. П., Хомченко И. Г. Задачи по химии для поступающих в вузы. М.: Высш. шк., 1986—2002.
4. Мовсумзаде Э. М., Аббасова Г. А., Захарочкина Т. Г. Химия в вопросах и ответах с использованием ЭВМ. М.: Высш. шк., 1991.
5. Лидин Р. А., Молочко В. А. Химия для абитуриентов. М.: Химия, 1994.
6. Справочник школьника. Химия. М.: ТКО «АСТ», 1996—2002.
7. Справочник школьника: Решение задач по химии. М.: ТКО «АСТ». 1996.
8. Кузьменко Н. Е., Еремин В. В. Химия: тесты для школьников и поступающих в вузы. М.: ОНИКС 21 век; Мир и образование, 2002.
9. Кузьменко Н. Е., Еремин В. В. 2500 задач по химии с решениями (для поступающих в вузы). М.: ОНИКС 21 век; Мир и образование, 2002.
10. Кузьменко Н. Е., Еремин В. В. Химия 8—11-е классы: пособие для средней школы. Изд. 2-е, стереотипное. М.: Экзамен, 2002.
11. Кузьменко Н., Еремин В., Попков В. Химия для школьников старших классов и поступающих в вузы. М.: ОНИКС 21 век; Мир и образование, 2002.
|
|
12. Большой справочник «Химия» (для школьников и поступающих в вузы). М.: Дрофа, 1999.