Лабораторная работа № 3
Определение координационного числа
Комплексного соединения титрометрическим методом
Краткие теоретические положения.
При приливании к раствору нитрата серебра достаточного количества раствора аммиака концентрация свободных ионов серебра в растворе чрезвычайно сильно уменьшается в связи с образованием аммиачного комплекса серебра:
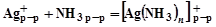 .
.
Цель работы: определить состав комплексного иона 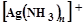 , т. е. координационное число серебра.
, т. е. координационное число серебра.
Приборы и реактивы: конические колбы емкостью 200 см3 для титрования – 4 шт.; градуированная пипетка емкостью 10 см3 – 2 шт.; бюретка емкостью 25 см3 – 1 шт.; мерный цилиндр емкостью 100 см3 – 1 шт.; 0.01 М раствор нитрата серебра; 0.01 М раствор бромида калия; ~2 М водный раствор аммиака.
Порядок выполнения работы.
В каждую из четырех плоскодонных колб налейте по 20 см3 0,010 М раствора AgNO3 и прибавьте в первую колбу 10 см3 2 М раствора аммиака, во вторую – 15 см3, в третью – 20 см3 и в четвертую – 30 см3 того же раствора. Затем в каждую колбу добавьте дистиллированной воды в таком количестве, чтобы объем каждого раствора составлял 95 см3.
В бюретку налейте 0,010 М раствор КВr и определите титрованием объем раствора КВr, прилитый в каждую из колб, достаточный для образования неисчезающего, но очень слабо взвешенного в растворе осадка бромида серебра.
Повторите еще раз все четыре опыта, но теперь добавьте в каждую колбу дистиллированной воды в таком количестве, чтобы после титрования суммарный объем раствора был как можно более близок к 100 см3.
Предполагая, что суммарный объем раствора после титрования равен 100 см3 и что количество образовавшегося осадка AgBr крайне мало,рассчитайте концентрации аммиака и бромид-ионов в каждом из растворов.
Постройте на графике зависимость концентрации бромид-ионов относительно концентрации аммиака. Опишите полученную зависимость линейной функцией и получите уравнение зависимости концентрации бромид-ионов от концентрации аммиака.
При прибавлении ионов Вr– к раствору, содержащему ионы серебра в избытке аммиака, первые следы осадка AgBr образуются в тот момент, когда произведение концентраций ионов серебра и брома достигает величины произведения растворимости:
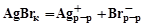 ,
,
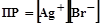 .
.
Концентрация ионов брома известна пo результатам титрования, концентрация ионов серебра определяется константой нестойкости комплексного иона, состав которого требуется определить:

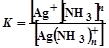
Подставляя в выражение константы нестойкости концентрацию ионов серебра из произведения растворимости
 ,
,
находим вид зависимости концентрации ионов брома от концентрации ионов аммиака в момент образования осадка AgBr:
 ,
,
откуда
 .
.
Прологарифмируем полученное выражение:
 .
.
В последний член полученного уравнения входят постоянные величины: произведение растворимости, константа нестойкости и концентрация комплексного иона (она постоянна, так как к одному и тому же количеству нитрата серебра прибавляется избыток раствора аммиака). Обозначим последний член уравнения через А. Тогда
 .
.
Так как для каждого опыта концентрации ионов Вr– и аммиака известны, то получено линейное уравнение, в котором А и n – постоянные коэффициенты. Для их нахождения достаточно построить систему из двух уравнений с известными концентрациями Вr– и NH3.
Предположим, что в первом опыте на титрование пошло некоторое количество бромида калия и после расчета были найдены концентрации бромид-ионов и аммиака соответственно: [Br–]1 и [NН3]1. Пусть во втором опыте аналогично были получены [Вr–]2 и [NН3]2. Решаем систему из двух уравнений:

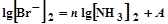
откуда




наконец,
 .
.
Так как во всех опытах конечный объем раствора был постоянным (100 см3), то вместо концентраций можно пользоваться непосредственно объемами растворов аммиака и бромида калия.
Объедините попарно результаты всех четырех опытов и, решив системы уравнений, вычислите координационное число серебра в комплексе  . Вычислите среднее значение п. Каковы причины отклонения значения п от целого числа?
. Вычислите среднее значение п. Каковы причины отклонения значения п от целого числа?
Постройте график зависимости  от
от 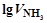 , и по наклону полученной прямой определите n.
, и по наклону полученной прямой определите n.