Реакции окисления металлов обратимы, и поэтомуоксиды способны диссоциировать (превращаться в исходные элементы).
Напишем в общем виде такую реакцию:
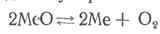
Если МеО и Me — чистые вещества, то единственным газообразным продуктом является кислород. В таких гетерогенных системах константа равновесия определяется одним парциальным давлением кислорода:

Величину ро2 — давление свободного кислорода, отвечающее состоянию равновесия реакции,— называют упругостью диссоциации данного оксида МеО. Иначе говоря, упругость диссоциации химического соединения есть концентрация единственного газообразного компонента в равновесной системе, выраженная в атмосферах.
Упругость диссоциации данного оксида МеО определяет соотношение между неокисленным Ме и МеО, и таким образом, может служить показателем сродства к кислороду элемента М.
Если в замкнутом объеме, где протекает реакция, давление снизилось за счет превращения кислорода в оксид металла, значит, реакция сместилась в сторону окисления металла.
Повышение давления свободного кислорода в объеме проведения реакции означает смещение реакции в сторону диссоциации окисла (восстановления атомарных компонентов), неустойчивость данного окисла, и, соответственно, низкую степень окисляемости данного элемента.
"Чем меньше значение упругости диссоциации химического соединения (оксида), тем прочнее этот оксид.» (парциальное давление кислорода ниже ® значит его меньше ® реакция диссоциации смещена влево ® окисел прочен ® он активен по отношению к кислороду)
В самом деле, чем меньше, при прочих равных условиях, давление (или концентрация) свободного кислорода, отвечающее состоянию равновесия реакции, тем большее его количество связано в оксид и тем легче образуется последний. Наоборот, чем большее давление (или концентрация) свободного кислорода отвечает состоянию равновесия реакции, тем меньшее его количество связано в оксид, т. е. тем меньше сродство элемента к кислороду.
Так как упругость диссоциации совпадает с константой равновесия, то для ее определения могут быть использованы термодинамические методы, применяемые для вычисления констант.
Для оценки направления хода реакции необходимо сравнить табличное значение упругости диссоциации оксида (ро2) и парциальным давлением кислорода в газовой фазе (ро2 факт.)
В зависимости от соотношения между упругостью диссоциации оксида ро2и действительным парциальным давлением кислорода в газовой фазе ро2 атм оксид или диссоциирует, или образуется.
Возможны три соотношения этих величин:
1) ро2 оксида = ро2 атм — реакция находится в состоянии равновесия;
2) ро2 оксида > ро2 атм — имеет место восстановление данного элемента из оксида, которое протекает тем энергичнее и полнее, чем больше разность ро2 - ро2 атм.
3) ро2 оксида < ро2 атм — наблюдается окисление элемента кислородом, протекающее тем энергичнее и полнее, чем больше разность ро2 - ро2 атм.
Парциальное давление кислорода воздуха в обычных условиях равно 0,21 am. Упругость диссоциации большинства оксидов очень мала - значительно меньше парциального давления кислорода воздуха. Поэтому естественное состояние подавляющего большинства металлов — окисленное.
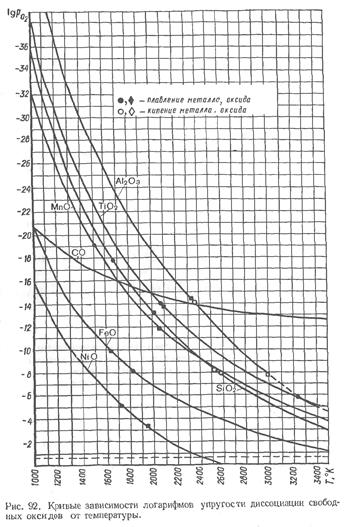
На рис. 92 показаны кривые зависимости логарифмов упругости диссоциации для различных оксидов от температуры. Пунктирная прямая отвечает парциальному давлению кислорода в воздухе, что позволяет сопоставить сродство рассматриваемых элементов к кислороду.
Анализ приведенных на рис. 92 данных дает возможность сделать следующие основные выводы:
1. С увеличением температуры значение упругости диссоциации для всех оксидов увеличивается, что говорит об уменьшении стойкости оксидов и, соответственно, снижении интенсивности окисления элементов.
2. Все кривые упругости диссоциации оксидов лежат выше прямой, отвечающей парциальному давлению кислорода воздуха. Это означает, что в рассматриваемом интервале температур будут существовать оксиды. Исключение составляет закись никеля NiO, у которой при температуре выше 2400 °К значение упругости диссоциации становится выше парциального давления кислорода воздуха. Таким образом, при температуре выше 2400 К никель будет самопроизвольно восстанавливаться из оксида.
3. Чем выше расположена соответствующая кривая упругости диссоциации оксида, тем прочнее он и тем более сильным раскислителем будет элемент, образовавший с кислородом данный оксид.
4. По убывающей силе сродства рассмотренных элементов к кислороду их можно расположить в следующих два ряда:
- при температуре 3500 °К: С; Ti; Al; Мп; Si; Fe; Ni;
- при температуре 1700 °К: AI; Ti; Si; С; Мп; Fe; Ni.
Сопоставление этих рядов показывает, что с понижением температуры раскисляющая способность углерода падает, а при температуре, отвечающей затвердеванию стали или близкой к ней, более энергичными раскислишлями становятся алюминий, титан и кремний.
Приведенные данные позволяют оценить сродство к кислороду различных элементов, дать сравнение прочности их оксидов и, главное, выявить перечень компонентов, которые можно использовать для раскисления железа или иных легирующих материалов.