другие же оксиды, например MnO; Si02; А1203, ТiО2, в нем практически не растворяются.
Углерод и водород, находящиеся в металле, дают газообразные оксиды (СО и Н2О), нерастворимые в жидком металле и большей частью успевающие покинуть его до затвердевания (СО, Н20). Однако в известных условиях часть их может остаться в металле и вызвать пористость.
Возможны следующие три основных вида окисления составляющих металла и шлака:
1) прямое окисление;
2) окисление низших оксидов до высших;
3) окисление на основе обменных реакций.
1. Прямое окисление в общем виде может быть представлено реакцией

Окисление элемента происходит непосредственно свободным кислородом с образованием соответствующего оксида. Такие процессы за редким исключением сопровождаются выделением тепла, т. е. они экзотермичны. …
Поставщиками свободного кислорода в зону сварки, помимо воздушной атмосферы, могут быть двуокись углерода С02, пары воды, карбонаты (HCO2-1) и высшие оксиды (Fe2O3), диссоциирующие при нагреве и выделяющие свободный кислород.
На поверхности же открытой сварочной ванны интенсивность прямых окислительных реакций значительно выше, чему способствует их экзотермический характер.
Однако все реакции, идущие с выделением тепла, в том числе и окислительные, при высоких температурах протекают вяло. почему?
2. Окисление низших оксидов до высших: 2FeO + О ® Fe2O3
3. Окисление на основе обменных реакций представляется в общем виде следующим уравнением:

где Me1, и Ме2 — различные металлы.
На направление обменных реакции помимо внешних условий существенно будут влиять концентрация реагирующих веществ, сродство элементов к кислороду и температура.
|
|
Виды раскислительных процессов.
Обменные реакции по отношению к металлу могут иметь не только окислительный, но и восстановительный характер (если равновесие реакции сдвигается влево). Для этого следует применять элементы, которые обладают повышенным сродством к кислороду и в определенных условиях способны энергично связывать кислород, освобождая металл из оксида. Такие элементы называются раскислителями, а сам процесс восстановления металла из оксида - раскислением.
Рассмотрим процессы раскисления FeO, отличающиеся методами вывода продуктов реакции из сварочной ванны.
Раскисление с получением оксидов, нерастворимых в металле
И всплывающих в шлак.
К числу раскислителей, образующих такие оксиды, относятся Ti, Si, Мn, Аl и др.
В общем виде реакция раскисления железа представляется таким уравнением:

где Ра — раскислитель.
Константа равновесия реакции

Но в сталях [Fe] ~1, поэтому равновесная концентрация свободной закиси железа в металле

Следовательно, концентрация свободной закиси железа уменьшается с повышением содержания раскислителя и уменьшением концентрации оксидов данного раскислителя в металле. Если же учесть, что раскислителями, как правило, служат элементы, образующие нерастворимые в металле оксиды, удаляемые в шлак, то концентрацию [Pan0m] можно считать величиной постоянной. Тогда, включая величину [Pan0m] в константу равновесия реакции, получим
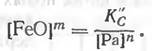
Таким образом, для определенных температур можно установить зависимость между концентрацией раскислителя и находящейся с ней в равновесии концентрацией свободной закиси железа. Тогда, задаваясь допустимым содержанием [FeO], определяют отвечающую этому содержанию концентрацию раскислителя в металле.
|
|
Рассмотрим характерные черты наиболее важных раскислителей этой группы, применяющихся в сварочной технике:
1. Кремний — Si (Тпл = 1440 °С; Ткип = 2630 ºС; ρ =2,37 г/см3). При окислении образует нерастворимый в расплаве железа кислотный оксид Si02, который легко создает комплексы, в том числе и с FeO. Силикаты железа всплывают на поверхность металла и переходят в шлак, вследствие чего раскисляющая способность кремния не снижается.
С повышением концентрации кремния в металле уменьшается содержание в нем закиси железа.
При этом раскисляющая способность кремния заметно увеличивается с понижением температуры.
Так как оксиды кремния увеличивают кислотность шлака, а вместе с тем и его вязкость, введение кремния в сварочную ванну ограничивают.

2. Марганец Мп (Тпл = 1244 °С; Ткип = 2027 ºС; ρ =7,46 г/см3). При окислении марганец превращается в закись MnO — относительно сильный основной оксид, нерастворимый в металле.
Закись марганца образует с закисью железа непрерывный ряд растворов как в жидком, так и в твердом состоянии. Взаимное физическое растворение их приводит к уменьшению содержания в шлаке свободной закиси железа, и
поэтому создаются условия для соответствующего перехода из металла в шлак новых порций FeO.
Как и для кремния, с увеличением содержания марганца в металле уменьшается концентрация в нем закиси железа, однако влияние кремния сказывается сильнее.
|
|
С увеличением температуры действие марганца как восстановителя слабеет.
3. Титан Ti (Тпл = 1660 °С; Ткип = 3260 ºС; ρ = 4,54 г/см3) относится к числу сильных раскислителей, более сильных, чем кремний и марганец. Образующийся кислотный оксид ТiО2 нерастворим в металле, легко вступает в комплексы, переходящие в шлак.