Расчет константы химического равновесия. Расчет равновесных концентраций, равновесных парциальных давлений реагентов. Составление таблицы материального баланса.
Пример 1. Запишите выражения для Кс и Кр и рассчитайте ихзначения для реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и 1000 К. Сделайте качественные выводы по полученным значениям о выходе продукта реакции при данных температурах и о влиянии температуры на величину константы равновесия.
Решение. Запишем выражения для констант равновесия данной реакции, принимая во внимание, что реакция гетерогенная и вещество графит С(к) находится в твердом состоянии:
Кр = 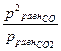 ; Кс =
; Кс = 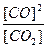 .
.
Используя табличные данные термодинамических функций состояния веществ (приложение 2 [1]), рассчитаем энтальпию и энтропию заданной реакции (см. пример 2, П5 и пример 1, П6); в результате получим:
∆ rН 0298 = 172,5 кДж, ∆ rS 0298 = 175,66 Дж/К.
Для расчета энергии Гиббса применим приближенную формулу:
∆ rG 0 Т = ∆ rH 0298 − T ∆ rS 0298.
В результате получим:
∆ rG 0298 = 172,5 – 298 · 175,66·10−3 = 120,15 кДж, то есть ∆ rG 0298> 0;
∆ rG 01000 = 172,5 – 1000 · 175,66 · 10−3 = −3,16 кДж, то есть ∆ rG 01000 < 0.
По уравнению: KP = exp ( )
)
рассчитаем Кр при 298 К и 1000 К:
Кр 298= exp(−120·103/8,31·298)= = ехр(−48,5) << 1;
Kp 1000 = exp(+316/8,31 · 1000) = ехр(0,038) = 1,039.
По формуле
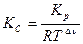
находим: Кс, 1000 = = 1,039/0,082·1000 = 0,013, так как ∆ν = 2 − 1 = 1.
По полученным данным можно сделать вывод, что при 298 К константа равновесия Кр стремится к нулю, что говорит о том, что в равновесной смеси практически отсутствуют продукты реакции и равновесие реакции сильно смещено в сторону исходных веществ. С ростом температуры величина константы равновесия возрастает (реакция эндотермическая) и при 1000 К
Кр уже больше 1, то есть в равновесной смеси начинают преобладать продукты реакции, их выход растет с ростом температуры.
Пример 2. Определите температуру, при которой в реакции
СаСО3(к) = = СаО(к) + СО2(г)
равновесное парциальное давление СО2 р СО2 = 104 Па.
Решение. Для данной гетерогенной реакции запишем выражение для константы равновесия: Кр = р СО2, то есть константа равновесия равна относительному парциальному давлению СО2 при данной температуре. Для искомой температуры Кр = р СО2 = 104/105 = 0,1.
Используя табличные данные термодинамических функций состояния веществ (приложение 2 [1]); получаем
∆ rH 0298 = 178,1 кДж; ∆ rS 0298 = 160,5 Дж.
Пренебрегая зависимостью ∆ rH 0 и ∆ rS 0 от температуры, воспользуемся формулами
∆ rG 0 Т = ∆ rH 0298 – T ∆ rS 0298и ∆ rG 0 Т = − RT ln Кр.
Приравняем друг другу два выражения для ∆ rG 0 Т:
∆ rG 0 Т = ∆ rH 0298 – T ∆ rS 0298 = = − RT ln Кр, в результате расчета имеем:
∆ rG 0 Т = = 178,1∙103 – Т 160,5 = −8,31 . Т ln0,1.
Решая полученное уравнение относительно Т, находим Т = 991 К.
Пример 3. Зная исходные и равновесные концентрации газообразных реагентов гетерогенного химического процесса, определите изменение общего давления в реакторе к моменту установления равновесия в системе
H2 (г) + I2 (к) → 2HI (г)
если исходная концентрация: с Н2 = 40 моль/м3, а равновесные концентрации: [H2] = 10 моль/м3; [HI ] = 60 моль/м3.
Решение. В исходной гетерогенной системе присутствовало одно газообразное вещество – водород, поэтому общее давление в системе определялось только парциальным давлением водорода. Используя основной газовый закон
p = cRT,
определим исходное парциальное давление водорода, равное общему давлению в исходной системе:
p общ = р Н2 = 40 .8,31 . 400 = 133 кПа.
В равновесной гетерогенной системе присутствуют два газа: водород и иодид водорода. Используя основной газовый закон, по известным равновесным концентрациям определим равновесные парциальные давления газов:
р Н2 = 10 .8,31 . 400 = 33,3 кПа,
р НI = 60 .8,31 . 400 = 199,7 кПа.
Общее давление в равновесной гетерогенной системе определяется суммой равновесных парциальных давлений входящих в нее газов и составляет:
p общ = р Н2 + р НI = 33,3 + 199,7 = 233 кПа.
Пример 4. Для гетерогенной химической реакции
H2 (г) + I2 (к) → 2HI (г)
рассчитайте значения равновесных концентраций реагентов, если исходная концентрация водорода составляла 1 моль / л, KС = 0,2.
Решение. Пусть к моменту равновесия прореагировало x моль / л водорода. Тогда, согласно стехиометрическим коэффициентам уравнения химической реакции, образовалось 2 x моль / л иодида водорода, концентрация твердого реагента не изменилась.
Составим таблицу материального баланса:
| Компонент | H2 (г) | I2 (к) | HI (г) |
| исходная концентрация с 0, моль/л | - | ||
| прореагировало ∆с, моль/л | x | - | 2 x |
| равновесная концентрация с равн, моль/л | 1 − x | - | 2 x |
Запишем константу гетерогенного химического равновесия через равновесные концентрации газообразных реагентов

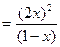 = 0,2
= 0,2
и, решая квадратное уравнение, рассчитаем количество прореагировавшего водорода (x моль / л): x 1 = 0,2; x 2= - 0,25. Отрицательное значение x не подходит по смыслу. Следовательно, расновесные концентрации газообразных реагентов гетерогенной химической реакции составляют:
[H2] = (1- x) = 1- 0,2 = 0,8 моль /л,
[HI ] = 2 x = 2 . 0,2 = 0,4 моль /л.