ОКСИДЫ.
Оксидами называются сложные вещества, состоящие из двух химических элементов, один из которых кислород.
Номенклатура оксидов.
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
При составлении формул оксидов необходимо помнить, что молекула всегда электронейтральна, т.е. она содержит одинаковое число положительных и отрицательных зарядов. Степень окисления кислорода в оксидах всегда – 2. Выравнивание зарядов производят индексами, которые ставят внизу справа у элемента.


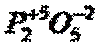

Характерная степени окисления элементов определяется следующим образом:
I группа – в основном +1,
II группа – в основном +2,
III группа – в основном +3,
IV группа – в основном +2, +4 (четные числа),
V группа – в основном +3, +5 (нечетные числа),
VI группа – в основном +2, +4, +6 (четные числа),
VII группа – в основном +3, +5, +7 (нечетные числа).
Классификация оксидов.
По химическим свойствам оксиды делятся на две группы:
Несолеобразующие – не образуют солей, например: NO, CO,
H2O;
2) солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
1.1. Основные оксиды
Основныминазываются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам соответствуют основания. Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Получение
1. Непосредственное взаимодействие металла с кислородом:
2Mg + O2  2MgO.
2MgO.
2. Горение сложных веществ:
2FeS + 3O2  2FeO + 2SO2.
2FeO + 2SO2.
3. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
CaO + CO2.
4. Разложение оснований:
Ca(OH)2  CaO + H2O.
CaO + H2O.
Физические свойства
Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого.
Химические свойства
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2.Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2  CaSiO3
CaSiO3
4.Взаимодействие с амфотерными оксидами:
СaO + Al2O3  Сa (AlO2)2.
Сa (AlO2)2.
Кислотные оксиды
Кислотныминазываются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты. Например, оксиду серы (IV) соответствует сернистая кислота H2SO3
Получение
1. Горение сложных веществ:
CH4 + 2O2 → CO2 + 2H2O.
2. Разложение кислородосодержащих кислот:
H2SO4  SO3 + H2O.
SO3 + H2O.
3. Взаимодействие неметалла с кислородом:
S + O2  SO2.
SO2.
4. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
CaO + CO2.
Физические свойства
Кислотные оксиды могут быть твердыми, жидкими и газообразными: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный,. SO3 – жидкий. К воде относятся по-разному (Р2О5 – растворимый, SiO2 – нерастворимый).
Химические свойства
1. Взаимодействие с водой с образованием кислоты:
P2O5 + 3H2O → 2H3PO4.
2. Взаимодействие со щелочами с образованием соли и воды:
SO3 + 2NaOH → Na2SO4 + H2O.
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4.
Амфотерные оксиды
Оксиды,гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными .
Например: оксид алюминия Al2O3,
оксид марганца (IV) MnO2.
Получение
Способы получения амфотерных оксидов аналогичны основным оксидам.
Физические свойства
Поскольку это оксиды металлов, то они, как и основные оксиды, твердые вещества, мало или нерастворимые в воде. (Al2O3 – нерастворим в Н2О). Некоторые из них имеют характерную окраску (Fe2О3 – бурый).
Химические свойства