Физические свойства сероводорода.
H2S - бесцветный газ, с резким характерным запахом (тухлых куриных яиц), ядовит, хорошо растворим в воде, поэтому собирать H2S методом вытеснения из воды нельзя.H2S немного тяжелее воздуха, поэтому можно его собирать методом вытеснения воздуха.
Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства H2S.
Горение сероводорода.
В воздухе горит синим пламенем:
2H2S + 3O2 = 2H2O + 2SO2
при недостатке кислорода:
2H2S + O2 = 2H2O + 2S (на этой реакции основан промышленный способ получения серы).
Сероводородная кислота H2S.
H2S образуется при растворении сероводорода в воде, является слабой кислотой.
Диссоциация H2S:
I. H2S ↔ H+ + HS- (гидросульфид-ион)
II. HS- ↔ H+ + S2- (сульфид-ион)
Поэтому H2S образует 2 ряда солей: кислые (NaHS, KHS) - гидросульфиды и средние (Na2S, K2S) - сульфиды.
Взаимодействие со щелочами.
H2S + 2NaOH = Na2S + 2H2O (средняя соль при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Взаимодействие с оксидами металлов.
H2S + Na2O = Na2S + H2O
3. H2S - кислота-восстановитель:
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
4. Качественная реакция на H2S и ее соли - взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца:
H2S +Pb(NO3)2 = PbS↓ + 2HNO3
черный
Получение сероводорода.
1. Взаимодействием разбавленных кислот с сульфидами:
FeS + 2HCl = FeCl2 + H2S ↑
H2SO4 - серная кислота.
Физические свойства H2SO4.
H2SO4 - при обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха,плотность 1,84 г/см3, нелетучая, хорошо растворима в воде – с сильным нагревом; очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
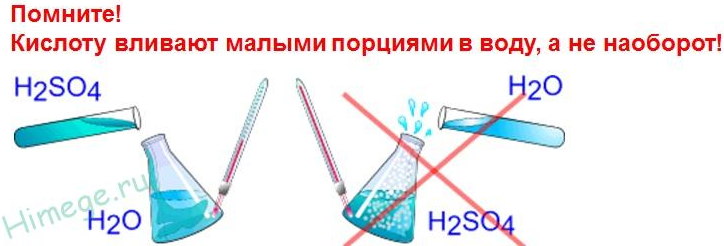
Теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
| - строение молекулы серной кислоты |
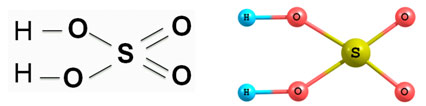
H 2 SO 4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
H2SO4 ↔ H+ + HSO4-
гидросульфат-ион
HSO4- ↔ H+ + SO42-
сульфат-ион
Суммарное уравнение:
H2SO4 ↔ 2H+ + SO42-
Являясь кислотой двухосновной, серная кислота диссоциирует по двум ступеням и образует 2 ряда солей:
Ø гидросульфаты (NaHSO4, KHSO4)
Ø сульфаты (Na2SO4, K2SO4, CaSO4, BaSO4)
Химические свойства H2SO4.
Особенность взаимодействия с металлами.
Разбавленная H2SO4.
| Ме до Н2 |
| H2SO4(разб) |
| Ме после Н2 |
| Соль + Н2 |
| не реагируют |
| Окислитель - ион Н+ |
Fe + H2SO4 = FeSO4 + H2↑
Cu + H2SO4≠
| Концентрированная H2SO4. |
| H2SO4(конц) |
| Щелочные и щелочно-земельныеМе |
| Fe, Al, Cr |
| пассивируют (на холоде) |
| Соль, H2S↑, H2O |
| Тяжелые Ме (Pb, Cu, Hg, Ag) |
| Соль, SO2↑, H2O |
| Благородные Ме (Au, Pt, Pd) |
| не реагируют |
| Соль, S, H2O |
 |
| Mg, Zn |
| t |
H2SO4(конц) + Me (Fe, Al, Cr) → Me2(SO4)3 +SO2↑+ H2O
2. Взаимодействие H2SO4 (конц) с неметаллами.
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
5H2SO4 (конц) + 2P =2H3PO4+ 5SO2↑ + 2H2O
2H2SO4 (конц) + C=CO2↑+ 2SO2↑ + 2H2O
2H2SO4 (конц) + S = 3SO2↑ + 2H2O