Скорость электрохимической реакции
как гетерогенной реакции определяется изменением числа молей n к единице поверхности электрода S (см. раздел "Химическая кинетика").
υ = (1/ S) dn / dt.
При использовании законов Фарадея эта скорость может быть выражена через плотность тока i = I / S. (n =m /M = i S t / zF)
υ = i / zF.
Эксплуатация химического источника тока или электролиз (см. далее) является неравновесными, чаще стационарными процессами и характеризуется величиной электродного потенциала φ отличающегося от равновесного φр. Их разность, как мы увидим далее, пропорциональная току, называется электродной поляризацией η= φ – φр.
В отношении отдельных составляющих (стадий) скорости гетерогенной электрохимической реакции используют термин перенапряжение.
1) Первая стадия – транспорт реагентов к электроду и продуктов от электрода в электролит.
2) Вторая, собственно электрохимическая стадия, связана с переходом электронов и ионов через границу раздела раствор – электрод. Эту стадию обычно сопровождают и дополняют предшествующие или последующие реакции а) химических и б) фазовых превращений.
Транспортное, диффузионное перенапряжение
Транспорт участников реакции осуществляется за счет
¨ миграции заряженных частиц, взаимосвязанной с числами переноса;
¨ диффузии в приэлектродный слой с необходимостью учета конвективной, потоковой ее составляющей.
Для простейшей электрохимической системы под током рассмотрим случай, когда транспорт ионов будет более медленной стадией по сравнению с электрохимической.
+ M │ C a M Mz+(C)M C k│ M –
Скорость установившегося, стационарного при к атодного процесса v к = vмигр + vдифф с учетом электрохимического её определения и конкретизацией диффузионной составляющей равна
i /(zF) = t к i /(zF) + D (C - C k) / δ,
где t k – число переноса для катионов; D - коэффициент диффузии ионов, δ – эффективная толщина диффузионного слоя.
   
| Концентрация катионов в обедненном прикатодном слое C k, которая и определяет неравновесный электродный потенциал под током, равна C k = C (1 – i /(z i пр)), где i пр = DFC /(δ (1 – t к)), - предельный ток. |
После подстановки C kв η к получаем искомое диффузионное перенапряжение катодного процесса как функцию тока
ηк= φ –φ равн = φº + (RT/ (zF)) ln C к–[φº +(RT /(zF)) ln C ]
ηк,а = (RT /(zF)) ln(1 – i /(z i пр)),
Для удобства графического отображения полученных зависимостей η(i)и обратной ей i (η)условимся внутри электрохимической ячейки считать ток, входящий в электрод – положительным, а выходящий – отрицательным. Последняя формула с учетом знака z принимает единый вид и для катода и для анода, а за ней следует обратная зависимость тока на электродах от перенапряжения.
η = (RT /(zF)) ln(1 – i / (z i пр)), i = z i пр (1 – exp (z y)),
где y = η RT / F – безразмерное перенапряжение. На катоде y, η <0, i → z i прпри η → - ∞. На аноде y, η > 0, а i → ∞ при увеличении η.
|
Рассмотренная модель диффузионного перенапряжения как для катодного, так и для анодного процессов учитывает миграцию заряженных частиц и их диффузию, в том числе конвективную.
Химическую составляющую (химическое перенапряжение) электродного процесса упрощенно представляют в виде промежуточных химических реакций, дополняющих собственно электродную Ox + z e– «Red.
Например, собственно электрохимической стадии катодного выделения меди (реакция (b)) из раствора Cu(CN)2– предшествует реакция (a) образования окислителя (Ox =CuCN)
Cu(CN)2– ® CuCN + CN– (a) CuCN + e– ® Cu + CN– (b).
Аналогичным образом в виде квазихимических реакций можно выразить и фазовое перенапряжение, т.е. торможение электродной реакции за счет сопутствующих фазовых превращений (образование газов, покрытий и т.д.). Например, для катодной электрокристаллизации металлов дополнительно учитывается стадия зародышеобразования.
В практических исследованиях перенапряжение делят на диффузионное и активационное. При такой расширенной трактовке выражения для катодного и анодного перенапряжений включают в себя соответствующие кинетические параметры.
 ,
,  ,
,
где i 0 - плотность тока обмена, кроме диффузионных, включает в себя и кинетические (активационные) характеристики гетерогенных электродных процессов.
В области малых перенапряжений | zy | << 1, exp (zy) ≈ 1+ zy
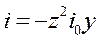 ,
, 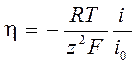 .
.
Вывод: при изготовлении электродов сравнения, обеспечивающих постоянство равновесного потенциала, используются системы с большим током обмена i 0.
В области больших перенапряжений z y >> 1
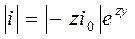 ®
® 
эмпирическое уравнение Тафеля используется, в частности, для характеристики электролитического выделения водорода. Например, для кислых растворов (H3O+ + e– ® 1/2 H2 + H2O)
| Металл | Pt | Au | Ni | Fe | Cu | Ag | Sn | Zn | Hg | Pb |
| a, В | 0,1 | 0,4 | 0,63 | 0,7 | 0,87 | 0,95 | 1,2 | 1,24 | 1,41 | 1,56 |
| b, В | 0,03 | 0,12 | 0,11 | 0,12 | 0,12 | 0,1 | 0,13 | 0,12 | 0,11 | 0,11 |
На величину поляризации существенно влияет состояние поверхности: ее уменьшает шероховатость; покрытие платиновой черни на поверхности платины снижает ее до нуля. Перенапряжение водорода падает с повышением температуры (за счет активационного увеличения i0).
Кстати, расчетное значение таффелевского коэффициента b = 0,118 В при β = 0,5 и Т = 298 К в большинстве случаев совпадает с наблюдаемыми величинами.
Механизм и последовательная теоретическая модель электродной поляризации до сих пор не установлены. На качественном уровне эксперимент интерпретируется совокупностью последовательных стадий.
1) массодоставка H+ (H3O+) из раствора к электроду;
2) адсорбция, дегидратация и разряд H+;
3) образование молекулярного водорода:  ;
;
4) десорбция с пузырьковым фазо-, точнее, газообразованием.
В настоящее время лимитирующей и определяющей считается вторая стадия "замедленного разряда". На величину перенапряжения водорода влияют состав раствора, pH, общая концентрация ионов, наличие ПАВ и т.д.
Величина водородного перенапряжения, нежелательная с точки зрения получения водорода, может играть положительную роль, например, в технологии электролиза водных растворов солей цинка. Вследствие высокого перенапряжения водорода на Zn потенциал его выделения (в нейтральном растворе  = –0,41 В) сдвигается в сторону отрицательных значений, благодаря чему возможно катодное осаждение металла (
= –0,41 В) сдвигается в сторону отрицательных значений, благодаря чему возможно катодное осаждение металла ( = –0,76 В) с выходом по току до 95 %.
= –0,76 В) с выходом по току до 95 %.
Режим электролиза для гальванического элемента – это принудительная реализация невыгодной восстановительной полуреакции путем создания избытка электронов, а значит отрицательного потенциала на катоде. Положительный потенциал на аноде от внешнего источника призван нейтрализовать электроны также невыгодной окислительной полуреакции.
Главное качество и назначение электролиза заключается в проведении ОВР, в более широком смысле процессов, самопроизвольное протекание которых по термодинамике невозможно. Например, разложение одномолярного раствора HCl (1 М) на элементы сопровождается возрастанием энергии Гиббса на 131,26 кДж/моль:
1/2 Cl2 + e– Cl– j°L = 1,36 В
H+ + e– ® 1/2 H2 j°R = 0
H+ + Cl– = 1/2 H2 + 1/2 Cl2, E ° = –1,36 В ® D G = – FE ° = 131,26 кДж/моль
Для осуществления электролиза, в соответствии с рис. 5.12. (I) к электролизёру необходимо приложить разность потенциалов или напряжение
U = U ′ + S U = ja – jk + S U,
которое кроме омического падения напряжения электролита, электродов и контактов S U, включает в себя разность потенциалов поляризованных электродов под током U ′ = ja – jk, называемую напряжением разложения электролита:
U ′ = jp,a + | ha | – (jp,k – | hk |) = jp,a – jp,k + | ha | + | hk | = U 0 + | ha | + | hk |.
Здесь указанные электродные потенциалы выражены через соответствующие равновесные потенциалы и электродные поляризации.

|
| Рис. 5.12.Катодные (1)и анодные (2) поляризационные кривые при электролизе (I) и работе гальванического элемента (II) |
При этом разность равновесных электродных потенциалов называется обратимым напряжением разложения электролита: U 0 = jp,a – jp,k, которое численно равно э.д.с. электрохимической ячейки в режиме гальванического элемента, и которое соответствует реакции, обратной реакции при электролизе. Например,  , T = 298,15 К.
, T = 298,15 К.
Напряжение разложения воды на платиновых электродах с учетом перенапряжений на электродах составляет U ' = 1,7 В. Эта же величина соответствует и кислородсодержащим кислотам и щелочам, поскольку при электролизе их водных растворов идет разложение воды.
Процессы, протекающие при электролизе, можно разбить на три группы:
1) При катодном осаждении металла с использованием растворимого анода из того же металла в случае равенства катодного и анодного выхода по току электродные реакции обратны друг другу и химических превращений в электролизере не происходит (пример электролиза CuSO4 с медными элктродами).
2) Электролиз раствора соляной кислоты - пример электролиза сопровождающегося химическим разложением электролита.:
3) Химические реакции, в которых участвуют различные компоненты электролита и растворитель.
Примером может служить электролиз кислого раствораKCl с инертным анодом:
| Возможные реакции на аноде | j°, В | Возможные реакции на катоде | j°, В |
| А1: 1/2 Cl2 + e– Clˉ | 1,36 | К1: К+ + e- ® К | -2,93 |
| А2: ¼ O2 + H+ + e- 1/2 H2O | 1,23 | К2: H+ + e– ® 1/2 H2 |
Выбор полуреакций по минимальной катодно-анодной разности потенциалов, соответствующей минимуму энергетических затрат, дает реакции А2 и К2, однако по меньшему перенапряжению вместо кинетически заторможенной реакции А2 с выделением кислорода следует выбрать А1 , с выделением хлора. Т.о. результирующая реакция соответствует сумме подчеркнутых: H+ + Clˉ = 1/2 H2 + 1/2 Cl2
Широкому практическому применению электролиза способствует высокое качество продуктов (например, чистота) и достаточная экономич-ность метода. Электролиз является практически единственным способом получения важнейших металлов, таких, как алюминий и магний. Существенное значение имеет электролиз раствора NaCl с получением хлора, водорода и щелочи, а также электролитический способ производства ряда препаратов (KMnO4, NaClO, бензидин, органические фторпроизводные и др.). Катодное осаждение металлов играет большую роль в металлургии цветных металлов и в технологии гальванотехники.
