
| 
|
| Экзотермическая реакция | Эндотермическая реакция |
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях.
Ингибитор — вещество, замедляющее или предотвращающее течение какой-либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном).
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Принцип ЛеШателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
· Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры.
· Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
· Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции.
· При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Закон действующих масс
О дин из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия.
Если реакция обратима, т. е. протекает одновременно в противоположных направлениях, то наблюдаемая скорость реакции r = r + – r -. При r+ = r- осуществляется химическое равновесие. Тогда, согласно уравнениям (2) и (3),

где К = k +/ k - — константа равновесия.
Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
-
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катионуводорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Молярная масса эквивалентов обычно обозначается как 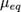 или
или 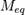 .
.
Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как  .
.
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. 
 Число эквивалентности
Число эквивалентности  представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности
представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности  связан с числом эквивалентности следующим соотношением:
связан с числом эквивалентности следующим соотношением:
Закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2=m2Э1
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Таблица – Расчет фактора эквивалентности
| Частица | Фактор эквивалентности | Примеры |
| Элемент |  ,
где В (Э) – валентность элемента ,
где В (Э) – валентность элемента
| 

|
| Простое вещество |  ,
где n (Э) – число атомов элемента (индекс в химической формуле), В (Э) – валентность элемента ,
где n (Э) – число атомов элемента (индекс в химической формуле), В (Э) – валентность элемента
| f Э(H2) = 1/(2×1) = 1/2; f Э(O2) = 1/(2×2) = 1/4; f Э(Cl2) = 1/(2×1) = 1/2; f Э(O3) = 1/(3×2) = 1/6 |
| Оксид |  ,
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В (Э) – валентность элемента ,
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В (Э) – валентность элемента
| f Э(Cr2O3) = 1/(2×3) = 1/6; f Э(CrO) = 1/(1×2) = 1/2; f Э(H2O) = 1/(2×1) = 1/2; f Э(P2O5) = 1/(2×5) = 1/10 |
| Кислота |  ,
где n (H+) – число отданных в ходе реакции ионов водорода (основность кислоты) ,
где n (H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
| f Э(H2SO4) = 1/1 = 1 (основность равна 1) или f Э(H2SO4) = 1/2 (основность равна 2) |
| Основание |  ,
где n (ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) ,
где n (ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
| f Э(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или f Э(Cu(OH)2) = 1/2 (кислотность равна 2) |
| Соль |  ,
где n (Ме) – число атомов металла (индекс в химической формуле соли), В (Ме) – валентность металла; n (А) – число кислотных остатков, В (А) – валентность кислотного остатка ,
где n (Ме) – число атомов металла (индекс в химической формуле соли), В (Ме) – валентность металла; n (А) – число кислотных остатков, В (А) – валентность кислотного остатка
| f Э(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или f Э(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку) |
| Частица в окислительно-восстановительных реакциях |  ,
где ,
где  – число электронов, участвующих в процессе окисления или восстановления – число электронов, участвующих в процессе окисления или восстановления
| Fe2+ + 2  ® Fe0
f Э(Fe2+) =1/2;
MnO4– + 8H+ + 5 ® Fe0
f Э(Fe2+) =1/2;
MnO4– + 8H+ + 5  ® ® Mn2+ + 4H2O
f Э(MnO4–) = 1/5 ® ® Mn2+ + 4H2O
f Э(MnO4–) = 1/5
|
| Ион |  ,
где z – заряд иона ,
где z – заряд иона
| f Э(SO42–) = 1/2 |