Тема 1.7. Электролиз расплавов и растворов электролитов.
Практическая работа: Свойства металлов. Электролиз солей.
Вопросы по ранее изученной теме:
- Что такое растворы?
- Какую роль играют растворы в природе, науке и технике?
- Что называется растворителем и растворенным веществом?
- Какие способы выражения состава раствора вы знаете?
- Какова массовая доля (%) соли в растворе, если растворить 15 г нитрата серебра в 1 л воды?
- Определите массовую долю растворенного вещества (%) NaCl, если в 380 г воды растворено 20 г NaCl. (Oтвет:5%).
- Сколько граммов КОН содержится в 200 мл 10% р-ра (плотность 1,09 г/см)? (Ответ: 21,8 г).
Электролиты не только диссоциируют на ионы, но и проводят электрический ток. При прохождении постоянного электрического тока через раствор (или расплав некоторых солей и оснований) электролита происходит следующее: положительно заряженные ионы (катионы) подходят к отрицательному электроду - катоду; отрицательно заряженные ионы (анионы) подходят к положительному электроду - аноду и за счет движения ионов проходит электрический ток.
Достигнув электродов, ионы начинают приобретать или терять электрооны: катионы, достигнув катода, принимают от него электроны, а анионы, достигнув анода - отдают электроны аноду; на катоде происходит процесс восстановления, на аноде - окисления. Эта реакция является окислительно-восстановительной.
Окислительно-восстановительные процессы, происходящие на электродах под воздействием постоянного электрического тока, называются электролизом.
При электролизе водных растворов кроме гидратированных ионов электролита принимают участие ионы из воды. Остановимся сначала на катодном процессе при электролизе водных растворов.
Чем левее располагается металл в ряду стандартных электродных потенциалов, тем труднее его ионы восстанавливаются на катоде.
1. Катионы, стоящие в ряду стандартных электродных потенциалов до Аl (Li+, К+, Са2+, Nа+, Мg2+, Аl3+), при электролизе водных растворов не восстанавливаются. На катоде выделяется водород из воды.
Например, электролиз раствора СаI2:
 |
 СаI2 Ca2+ + 2Iˉ
СаI2 Ca2+ + 2Iˉ
 H2O H+ + OHˉ
H2O H+ + OHˉ
Таким образом, на катоде выделяется водород, на аноде образуется йод, а вблизи катода - раствор Са(ОН)2:
СаI2 + 2H2O → Ca(OH)2 + H2 + I2↓
2. Катионы, стоящие в ряду стандартных электродных потенциалов от Мn до Н (Мn2+, Zn2+, Сr3+, Fе2+, Ni2+, Sn2+, Рb2+, Н+), при электролизе растворов восстанавливаются одновременно с молекулами воды.
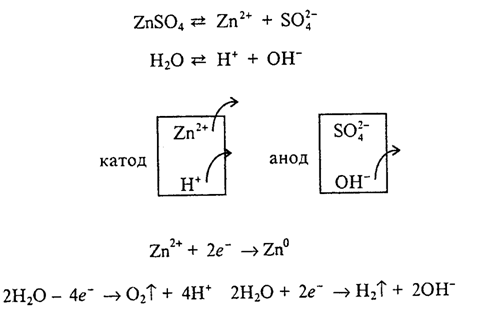 |
Например, электролиз раствора ZnSО4:
3. Катионы, стоящие в ряду стандартных электродных потенциалов после Н (Сu2+, Нg2+, Аg+, Рt2+, Аu3+), практически полностью восстанавливаются на катоде.
Например, электролиз раствора СuВr2:
 |
 СuВr2 Cu2+ + 2Brˉ
СuВr2 Cu2+ + 2Brˉ
 H2O H+ + OHˉ
H2O H+ + OHˉ
Рассмотрим анодные процессы. Анионы бескислородных кислот и их солей (F‾, Сl‾, Вr‾, I‾, S‾, СN2‾ и т.п.) удерживают свои электроны слабее иона ОН из воды. Поэтому при электролизе водных растворов солей бескислородных кислот окисляются анионы бескислородных кислот.
Например, электролиз раствора ВаСl2:
 |
Таким образом, при электролизе раствора ВаСl2 на катоде выделяется водород, на аноде - хлор, а в катодном пространстве накапливается Ва(ОН)2:
ВаСl2 + 2Н2O = Ва(ОН)2 + Сl2 + Н2↑
Ва2+ + 2Сl‾ + 2НОН = Ва2+ + 2ОН‾ + Сl2 + Н2
2Сl‾ + 2НОН = 2ОН‾ + Сl2 + Н2
Анионы кислородных кислот (NO3‾, SО32‾, СО32‾, РО43‾) удерживают свои электроны более прочно, чем ионы ОН. Поэтому при электролизе водных растворов солей кислород- содержащих кислот окисляется молекула воды, а ионы соли остаются без изменения:
2Н2О - 4 е ‾ = О2 + 4Н+
 |
Например, электролиз раствора Рb(NО3)2:
Таким образом, при электролизе раствора Рb(NО3)2 образуются следующие вещества: на катоде - Рb и Н2, в катодном пространстве - Рb(ОН)2, на аноде - О2, в анодном пространстве - НNО3:
2Рb(NО3)2 + 4Н2О = Рb + Рb(ОН)2 + Н2 + O2 + 4НNО3
2Рb2+ + 4NО3‾ + 4НОН = Рb + Рb(ОН)2 + Н2 + О2 + 4Н+ + 4NО3‾
Все разобранные случаи электролиза относятся к нерастворимому аноду, изготовленному из угля, графита, платины, иридия.
 |
В случае растворимого анода (Сu, Аg, Zn, Сd, Нg, Ni и др.) при электролизе водного раствора окисляется анод. Например, если при электролизе водного раствора СuСl2 анод будет медным, тогда хлорид-ионы не окисляются (растворяется анод):
Здесь происходит переход меди с анода на катод. Количество хлорида меди в растворе остается неизменным. Электролиз с растворимым анодом широко применяется для получения металлов высокой чистоты, для покрытия одного металла слоем другого (гальваностегия), для получения рельефных изображений (гальванопластика).
Вопросы и задания:
- В каких случаях при электролизе водных растворов солей:
a) на катоде выделяется водород;
b) на аноде выделяется кислород;
c) происходит одновременное восстановление катионов металла и катионов водорода воды?
- Какие химические процессы происходят у катода и анода при электролизе раствора хлорида никеля (II), если анод:
a) угольный;
b) никелевый?
Напишите уравнения происходящих реакций.
- Как протекает электролиз раствора нитрата натрия, если катод и анод сделаны из меди?
- В раствор хлорида олова (II) погрузили железное изделие и угольный стержень. К каким полюсам аккумулятора надо присоединить эти предметы, чтобы стальное изделие покрылось слоем олова?
- Изменится ли количество соли при электролизе водных растворов, если анод нерастворимый:
a) КСl;
b) Nа2СО3;
c) Сu(NО3)2?
Напишите уравнения реакций.
- Какие реакции протекают на электродах при электролизе NаОН:
a) в расплавленном состоянии;
b) в водном растворе?
Напишите уравнения реакций.
- В растворе содержатся сульфаты железа (III), цинка и хрома (III). Какой металл выделится в первую очередь при электролизе?
Карточка 1
Запишите уравнение электролиза раствора сульфата меди (II). Что называется электролизом?
Карточка 2
Сравните процессы электролиза и коррозии (укажите черты сходства и отличия). Запишите схемы, поясните. В каких областях применяется электролиз?
Карточка 3
Задача. Вычислите объем водорода, который может выделиться при взаимодействии 13 г цинка и 20 г серной кислоты.
Карточка 4
Какие виды коррозии вы знаете? В чем сущность электрохимической коррозии? Ответ подтвердите электронными уравнениями (схемы).
Работа классу 1
- 3адача. При электролизе раствора хлорида меди (II) на одном из электродов выделилась медь, массой 0,5 г. Какое вещество и какой массы выделится на другом электроде?
- Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются: медь и цинк; алюминий и железо?
- Почему?
- Запишите уравнение электролиза раствора нитрата калия.
Вопросы по изученной теме:
- В каких случаях при электролизе водных растворов солей:
a) на катоде выделяется водород;
b) на аноде выделяется кислород;
c) проходит одновременное восстановление катионов металла и катионов водорода воды?
- Какие процессы, протекающие на электродах, объединяются общим названием ''электролиз''?
- Чем отличаются электролиз расплава едкого натра от электролиза его раствора?
- С каким полюсом батареи - положительным или отрицательным должна быть соединена металлическая деталь при её хромировании.
- Раскрыть значение электролиз; понятие - электролиз.
- Какие химические процессы происходят у катода и анода при электролизе раствора иодида калия? Расплава иодида калия?
- Составьте схемы электролиза с использованием угольных электродов расплавов и растворов следующих солей: КСl.
- В какой последовательности будут восстанавливаться катионы при электролизе их солей одинаковой концентрации (анод нерастворимый) следующего состава: Al, Sn, Ag, Mn?
- Объясните, почему металлический калий нельзя получить на угольных электродах электролизом водного раствора хлорида калия, но можно получить электролизом расплава этой соли?
- При электролизе водного раствора нитрата серебра на катоде образуется:
a) Аg b) NО2 c) NO d) H2?
Литература: 1,3.
Тема 1.7. ПРАКТИЧЕСКАЯ РАБОТА ПО ТЕМЕ: