1.Массовая (процентная) доля – показывает, какая масса растворённого вещества содержится в 100г раствора [ω]=%
ω = 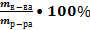
| Пример 1.В 450 граммах воды растворили 50 грамм вещества. Найти массовую долю вещества в растворе? | |
| Дано: m(в-ва) = 50 г m(H2O) = 450 г Найти: ω –? | Решение. m(р-ра) = 5 + 450 = 500 г 500 г – 100% 50 г – х х =10% |
2. Молярная концентрация CM – показывает количество растворённого вещества в моль в одном литре раствора [ CM ]= моль/л
CM = 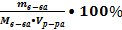
| Пример 2.Сколько грамм KOH содержится в 500 мл 5М раствора? | |
| Дано: V(KOH) = 500 мл СM(KOH) = 5 моль/л Найти: m(KOH) -? | Решение.
5 моль КОН содержится в 1 литре
Х моль КОН содержится в 0,5 литре
Х = 2,5 моль/л
n = 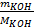 m(KOH) = n•MKOH = 2,5•56 = 140г.
m(KOH) = n•MKOH = 2,5•56 = 140г.
|
3. Молярная концентрация эквивалента (нормальная концентрация, нормальность) – Сэк (СН) – количество эквивалентов растворенного вещества в одном литре раствора [ Сэк ] = моль экв/л СН = 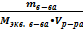
Эквивалент вещества – реальная или условная частица вещества, которая в данной реакции реагирует с одним атомом или ионом водорода, или одним электроном.
Фактор эквивалентности 1/z - доля реальной частицы вещества, которая эквивалентна одному иону водорода в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
z – небольшое целое число, равное числу эквивалентов вещества, содержащихся в 1 моль этого вещества.
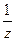 или fэкв(х) – фактор эквивалентности вещества, где z – всегда целое положительное число – 1,2,3,4 и т.д.
или fэкв(х) – фактор эквивалентности вещества, где z – всегда целое положительное число – 1,2,3,4 и т.д.
νэкв(х) или ν(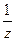 х) – количество вещества эквивалента, моль;
х) – количество вещества эквивалента, моль;
М(х) – молярная масса вещества, г/моль;
Мэкв(х) или М(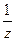 х) – молярная масса эквивалента вещества, г/моль;
х) – молярная масса эквивалента вещества, г/моль;
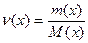 , для газов:
, для газов: 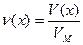 , где VМ – молярный объем газа, л/моль.
, где VМ – молярный объем газа, л/моль.
При н.у. VМ(любого газа)=22,4 л/моль.
Пример 3. Определение фактора эквивалентности
КИСЛОТЫ
Величина z фактора эквивалентности кислот определяется числом атомов водорода, которые могут быть замещены в молекуле кислоты на атомы металла.
| Определить факторы эквивалентности для кислот: а) НСl, б) Н2SO4, в) Н3РО4; г) Н4[Fe(CN)6]. Решение. а) z = 1, фактор эквивалентности – 1; б) z = 2; фактор эквивалентности - 1/2; в) z = 3; фактор эквивалентности - 1/3; г) z = 4; фактор эквивалентности – 1/4 |
В случае многоосновных кислот фактор эквивалентности зависит от конкретной реакции:
| а) H2SO4 + 2KOH → K2SO4 + 2H2O в этой реакции в молекуле серной кислоты замещается два атома водорода, следовательно, z = 2, фактор эквивалентности - 1/2. б) Н2SO4 + KOH → KHSO4 + H2O В этом случае в молекуле серной кислоты замещается один атом водорода, z = 1, фактор эквивалентности – 1. Для фосфорной кислоты, в зависимости от реакции, значения факторов эквивалентности могут быть: 1, 1/2,1/3. |
ОСНОВАНИЯ
Величина z основания определяется числом гидроксидных групп, которые могут быть замещены на кислотный остаток.
| Определить факторы эквивалентности оснований: а) КОН; б) Cu(OH)2; в) La(OH)3. Решение. а) z = 1, фактор эквивалентности – 1; б) z = 2, фактор эквивалентности – 1/2; в) z = 3, фактор эквивалентности – 1/3 |
Фактор эквивалентности многокислотных оснований может изменяться в зависимости от количества замещенных групп (также как и у кислот). Например, для гидроксида латана возможны значения фактора эквивалентности – 1, 1/2, 1/3.
СОЛИ
Значения факторов эквивалентности солей определяются по катиону. Величина z в случае солей равна q·• n, где q – заряд катиона металла, n – число катионов в формуле соли.
| Определить фактор эквивалентности солей: а) KNO3; б) Na3PO4; в) Cr2(SO4)3; г) Al(NO3)3 Решение. а) z = q •·n = 1, фактор эквивалентности – 1; б) z = 1·• 3 = 3, фактор эквивалентности – 1/3; в) z = 3·• 2 = 6, фактор эквивалентности – 1/6; г) z = 3·• 1 = 3, фактор эквивалентности – 1/3 |
Значение факторов эквивалентности для солей зависит также и от реакции, аналогично зависимости его для кислот и оснований.
В окислительно-восстановительных реакциях для определения факторов эквивалентности используют схему электронного баланса.
Число z для вещества в этом случае равно числу принятых или отданных электронов молекулой вещества.
К2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
для прямой Сr2+6 + 6 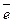 → 2Cr3+ 1/z(K2Cr2O7) = 1/6 (1/z (Cr) = 1/3)
реакции 2Cl- - 2 → 2Cr3+ 1/z(K2Cr2O7) = 1/6 (1/z (Cr) = 1/3)
реакции 2Cl- - 2 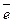 → Cl2 1/z (HCl) = 1 (1/z (Cl) = 1)
для обратной 2Cr+3 - 6 → Cl2 1/z (HCl) = 1 (1/z (Cl) = 1)
для обратной 2Cr+3 - 6 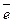 → Cr+6 1/z (CrCl3) = 1/3 (1/z (Cr) = 1/3)
реакции Cl2 - 2 → Cr+6 1/z (CrCl3) = 1/3 (1/z (Cr) = 1/3)
реакции Cl2 - 2 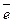 → 2Cl- 1/z (Cl2) = ½ (1/z (Cl) = 1) → 2Cl- 1/z (Cl2) = ½ (1/z (Cl) = 1)
|
| Пример 4. Сколько грамм Н2SO4 нужно взять для приготовления 200 мл 0,5н раствора. | |
| Дано: V = 200 мл CH = 0,5 моль/л Найти: m(Н2SO4) -? | Решение. СН(Н2SO4) = nэкв(Н2SO4) / Vр-ра nэкв(Н2SO4) = СН(Н2SO4) • Vр-ра = 0,5 • 0,2 = 0,1 моль nэкв(Н2SO4) = m(Н2SO4) / Мэкв(Н2SO4) Мэкв(Н2SO4) = М(Н2SO4) / 2 = 98/2 = 49 г/моль m(Н2SO4) = nэкв(Н2SO4) • Мэкв(Н2SO4) = 0,1 • 49 = 4,9 г |
4. Моляльная концентрация (Сm) − количество (моль) растворенного вещества в 1000 г чистого растворителя [ Сm ] = (моль/кг). Сm = 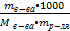
5. Мольная доля (Χ) −отношение количества вещества одного растворенного компонента раствора к общему количеству всех компонентов. Χв-ва = 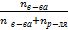
6. Титр – (Т) – число граммов растворённого вещества в 1 мл раствора [T] = г/мл
Т = 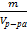 Т =
Т = 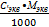
| Пример 5. Вычислить титр, молярную концентрацию, моляльную концентрацию, нормальную концентрацию раствора серной кислоты с ω = 10% ρ = 1,07 г/см3 | |
| Дано: ω(H2SO4) = 10% ρ = 1,07 г/см3 Найти: T, CM, CH, Cm -? | Решение
1) Пусть V = 1000 мл
m = 1000 • 1,07 = 1070 г
2) Найдем массу растворенного вещества
в 100 г раствора –10 г H2SO4
в 1070 г раствора – х г
Х = 10700/100 = 107 г
3) Найдем количество моль H2SO4 n = m / М = 107 / 98 = 1,09 моль
4) Найдем молярную концентрацию раствора
CM = 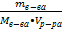 = 107 / 98 • 1 = 1,09 моль/л
5) Найдем нормальную (эквивалентную) концентрацию раствора
CH = = 107 / 98 • 1 = 1,09 моль/л
5) Найдем нормальную (эквивалентную) концентрацию раствора
CH = 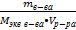 = 107 / 49 = 2,18 моль экв/л
6) Т = 107 / 1000 = 0,107 г/мл
7) Найдем массу серной кислоты, приходящуюся на 1000 г воды.
10% раствор
90 г воды– 10 г H2SO4
1000 г воды– х гH2SO4
Х = 111 г
Сm = = 107 / 49 = 2,18 моль экв/л
6) Т = 107 / 1000 = 0,107 г/мл
7) Найдем массу серной кислоты, приходящуюся на 1000 г воды.
10% раствор
90 г воды– 10 г H2SO4
1000 г воды– х гH2SO4
Х = 111 г
Сm = 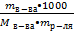 = = 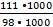 = 111 / 98 = 1,13 моль/л = 111 / 98 = 1,13 моль/л
|