Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

Кафедра общей и физической химии
Неорганическая химия
ЛАБОРАТОРНАЯ РАБОТА № 5
Исследование комплексных соединений
Выполнила: студентка ЭГР-05
Верхогляд М.С.
Проверил:
Иванов М.В.
САНКТ-ПЕТЕРБУРГ,
Цель работы - познакомиться с методами получения комплексных соединений и их свойствами.
Общие сведения.
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральными атомами, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
K3[Fe(CN)6]ó3K++[Fe(CN)6]3-
[Co(NH3)4(SO4)]Cló [Co(NH3)4(SO4)]++Cl
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4 с растворами солей бария.
Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда, соответственно, внешняя сфера отсутствует, например, [Pt(NH3)2Cl2].
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, но в русском – справа налево. При этом название внутренней сферы произносят в одно слово, используя соединительную гласную -о-, название комплексного аниона заканчивают суффиксом -ат. Молекулы воды в качестве лигандов обозначают термином «акво-», а молекулы аммиака – термином «аммино». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений мы назовем гексаноциферат (III) калия, второе – хлорид сульфатотетраамминокобальта (III), третье – дихлородиамминоплатина (II).
Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например, CN-, NH3 – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов: в первом примере – 6, в третьем примере –4. Однако во втором примере число лигандов равно 5, а координационное число кобальта – 6, поскольку сульфат-ион бидентатен.
Ход выполнения работы:
Образование комплексных соединений.
Опыт 1. Образование амминокомплекса серебра.
Наливаю в пробирку 3-4 капли раствора нитрата серебра, добавляю столько же раствора хлорида натрия (или хлорида калия).
AgNO3+NaCl=AgCl+NaNO3


Выпал белый осадок хлорида серебра. Затем в вытяжном шкафу добавляю в пробирку 3-5 капель концентрированного раствора аммиака и несколько раз встряхнула.
AgCl+2NH4OHK=[Ag(NH3)2]Cl+2H2O

Осадок растворился вследствие образования амминокомплекса серебра.
Опыт 2. Получение амминокомплекса никеля.
2NiSO4+2NH4OH=(NiOH)2SO4  +(NH4)2SO4
+(NH4)2SO4
образовался студенистый осадок сульфата гидроксоникеля.
(NiOH)2SO4+(NH4)2SO4+10NH4OH=2[Ni(NH3)6]SO4+12H2O
Получился раствор синего цвета.
Добавим 1мл насыщенного раствора бромида калия до выпадения в осадок бромида гексамминоникеля.

Опыт 3. Образование амминокомплекса меди.
Наливаю в пробирку 3-5 капель раствора сульфата меди (II) и добавляю по каплям концентрированный раствор аммиака.
CuSO4+4NH4OH=[Cu(NH3)4]SO4+4H2O
В первый момент выделяется синий осадок сульфата гидроксомеди (II), который затем растворяется вследствие образования амминокомплекса меди.
Опыт 4. Получение комплексного йодида ртути.
Наливаю в пробирку 3-4 капли раствора нитрата ртути (II) и добавляю 1-2 капли раствора йодида калия.
Hg(NO3)2+2KJ=HgJ2+2KNO3
Образуется оранжевый осадок дийодида ртути. В пробирку по каплям добавляем избыток раствора йодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата (2-).
HgJ2+2KJ=K2[Hg(J)4]

Этот анион можно выделить в осадок ионами серебра или кобальта (2+). Разделяю раствор тетрайодомеркурата на две части. В первую пробирку добавляю 1-2 капли раствора нитрата серебра, во вторую –1-2 капли раствора сульфата кобальта (II).
K2[Hg(J)4]+ Ag(NO3)2=Ag[Hg(J)4]+ 2KNO3
Выпадает желтый осадок.
K2[Hg(J)4]+ CoSO4=Co[Hg(J)4]+K2SO4
Выпадает розовый осадок.
Примечание: соли ртути ядовиты.
Опыт 5. Образование гидрокомплекса цинка.
Наливаю в пробирку 3-4 капли раствора сульфата цинка и добавляю по каплям 0,2 н. раствор гидроксида натрия, находящийся в штативе с реактивами, до выпадения осадка гидроксида цинка.
ZnSO4+2NaOH=Zn(OH)2+Na2SO4
Выпадает студенистый осадок. Затем в вытяжном шкафу добавляю по каплям 6 н. раствор едкого натра до полного растворения осадка вследствие образования комплексного аниона тетрагидроксоцинка (2-).
Zn(OH)2+NaOH(6N)=Na2[Zn(OH)4]
2. Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
Опыт 6. Образование труднорастворимого гексаноциферрата (III).
А. Наливаю в пробирку 3-4 капли раствора гексаноциферрата (II) калия K4[Fe(CN)6]. Добавляю 2-3 капли раствора трихлорида железа.
3K4[Fe(CN)6]+4FeCl3=Fe4[Fe(CN)6]3  +12KCl
+12KCl
Выпадает осадок цвета берлинской лазури, используемой для производства художественных красок. Реакция служит для обнаружения катионов Fe3+.
Б. Наливаю в пробирку 3-4 капли раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Добавляю 2-3 капли раствора сульфата железа (II).
2K3[Fe(CN)6]+3FeSO4=Fe3[Fe(CN)6]2  +3K2SO4
+3K2SO4
Образуется осадок, который в прошлом веке называли турнбулевой синью. В настоящее время установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, а именно: гексаноциферрат (III) железа (II) Fe3[Fe(CN)6]2. Данная реакция служит для обнаружения катионов Fe2+.
Опыт 7. Образование труднорастворимых гексаноциферратов (II).
Наливаю в две пробирки по 3-4 капли раствора гексаноциферрата (II) калия. В первую пробирку добавляю 2-3 капли раствора сульфата цинка, во вторую – столько же раствора сульфата меди (II).
2K4[Fe(CN)6]2+3ZnSO4=K2Zn3[Fe(CN)6]2+3K2SO4 (1 пробирка)
2K4[Fe(CN)6]2+3CuSO4=K2Cu3[Fe(CN)6]2+3K2SO4 (2 пробирка)
В первой пробирке образуется желтый густой осадок, а во второй пробирке образуется зеленый осадок.
Опыт 8. Образование труднорастворимого гексанитрокобальта (III) натрия-калия.
Реакция служит для обнаружения в растворах катионов калия. Наливаю в пробирку 3-4 капли раствора Na3[Co(NO2)6] и добавляю 2-3 капли раствора хлорида калия.
Na3[Co(NO2)6]+2KCl=K2Na[Co(NO2)6]  +2NaCl
+2NaCl
Образуется густой желтый осадок комплексной соли K2Na[Cp(NO2)6].
3. Реакции, сопровождающиеся разрушением комплексных ионов.
Опыт 9. Образование и разрушение амминокомплекса никеля.
Наливаю в пробирку 3-4 капли раствора сульфата никеля (II) и добавляю 2-3 капли концентрированного раствора аммиака до полного растворения образующегося в первый момент синего осадка сульфата гидроксоникеля. Образутся раствор синего цвета, обусловленного катионом гексаамминоникеля (2+).
NiSO  + 2NH
+ 2NH 


Затем добавляю в раствор 15 %-ную соляную кислоту до изменения синей окраски в жёлтую.

Ni - d-элемент. При замене лигандов 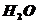 на
на  увеличивается скорость расщепления молекул, что пиводит к сдвигу полос поглощения в сторону меньших длин волн. При переходе к хлорокомплексу меняется координационное число с 6 до 4: окраска ослабевает, т.е. сдвиг полос поглощения смещается в сторону больших длин волн.
увеличивается скорость расщепления молекул, что пиводит к сдвигу полос поглощения в сторону меньших длин волн. При переходе к хлорокомплексу меняется координационное число с 6 до 4: окраска ослабевает, т.е. сдвиг полос поглощения смещается в сторону больших длин волн.
Следовательно комплексообразование, характерное для d-элементов позволяет растворять осадки некоторых соединений этих элементов, т.е. переводить их в раствор.
Вывод: Я познакомилась с методами получения комплексных соединений и выявила их свойства.