2.1. В таблице представлены экспериментальные данные [12] по кинетике восстановления оксида хрома водородом (α – степень восстановления):
| Т, К | Время t, час | ||||||
| α,% | 0,026 | 0,041 | 0,062 | 0,083 | |||
| 0,04 | 0,063 | 0,12 | 0,18 | 0,23 | |||
| 0,055 | 0,12 | 0,236 | 0,306 | 0,437 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.2. В таблице представлены экспериментальные данные [12] по кинетике восстановления оксида хрома с примесью железа водородом (α – степень восстановления):
| Т, К | Время t, час | |||||||
| α,% | 0,11 | 0,17 | 0,19 | 0,23 | 0,26 | 0,36 | ||
| 0,2 | 0,31 | 0,42 | 0,49 | 0,61 | 0,69 | |||
| 0,43 | 0,59 | 0,75 | 0,84 | 0,99 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.3. В таблице представлены экспериментальные данные [13] по кинетике восстановления оксида кадмия водородом (α – степень восстановления):
| 623 К | t, мин | |||||||||||||||
| α | 0,086 | 0,2 | 0,3 | 0,407 | 0,479 | 0,55 | 0,607 | 0,657 | 0,707 | 0,743 | 0,786 | 0,821 | ||||
| 643 К | t, мин | |||||||||||||||
| α | 0,15 | 0,293 | 0,4 | 0,479 | 0,579 | 0,657 | 0,736 | 0,771 | 0,821 | 0,857 | 0,886 | 0,914 | ||||
| 653 К | t, мин | |||||||||||||||
| α | 0,2 | 0,243 | 0,279 | 0,314 | 0,357 | 0,386 | 0,421 | 0,45 | 0,486 | 0,521 | 0,55 | 0,679 | 0,779 | 0,864 | 0,929 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления α со временем t. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.4. В таблице представлены экспериментальные данные [13] по кинетике восстановления оксида кадмия водородом (α – степень восстановления):
| T, К | t, мин | |||||||||
| α | 0,015 | 0,05 | 0,076 | 0,102 | 0,126 | 0,15 | 0,196 | 0,24 | ||
| α | 0,087 | 0,201 | 0,31 | 0,405 | 0,481 | 0,549 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления α со временем t. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.5. В таблице представлены экспериментальные данные [13] по кинетике восстановления оксида кобальта водородом (α – степень восстановления):
| T,K | t, мин | ||||||||
| α | 0,008 | 0,039 | 0,126 | 0,222 | 0,327 | 0,378 | 0,477 | 0,6 | |
| α | 0,021 | 0,09 | 0,278 | 0,419 | 0,53 | 0,578 | 0,687 | 0,744 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления α со временем t. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.6. В таблице представлены экспериментальные данные [14] по кинетике восстановления сферических гранул магнетита (различных размеров, dо) монооксидом углерода при 1223 К (α –степень восстановления, %).
| dо | ||||||||
| 1 мм | t, мин | 0,5 | 2,5 | |||||
| α, % | ||||||||
| 2 мм | t, мин | |||||||
| α, % | ||||||||
| 3 мм | t, мин | 26, | ||||||
| α, % | ||||||||
| 4 мм | t, мин | |||||||
| α, % |
Представить данные графически. Проанализировать. Проверить применимость к описанию кинетики известных выражений связи степени восстановленияα со временем. Сделать вывод о режиме протекания процесса. Задавшись плотностью магнетита 5 г/см3 и температурной зависимостью константы равновесия реакции восстановления магнетита 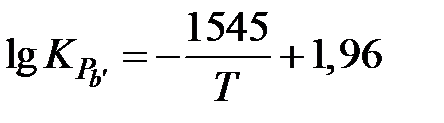 , вычислить константу скорости или коэффициент диффузии газа при температуре опытов.
, вычислить константу скорости или коэффициент диффузии газа при температуре опытов.
2.7. В таблице представлены экспериментальные данные по кинетике восстановления водородом кубиков гематита (rо = 14,3 мм) различной плотности и пористости при 1073 К (α – степень восстановления, %).
| ρ = 3,48 | t, мин | 27,5 | 47,5 | ||||||||||||
| П=26,5% | α, % | ||||||||||||||
| ρ = 4,28 | t, мин | ||||||||||||||
| П = 11% | α, % | 37,5 | 67,5 | 87,5 | |||||||||||
| ρ = 5,12 | t, мин | ||||||||||||||
| П = 0% | α, % | 12,5 | 62,5 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения α со временем t. Сделать вывод о режиме протекания процесса. Воспользовавшись исходными данными, результатами анализа и температурной зависимостью константы равновесия реакции восстановления гематита водородом 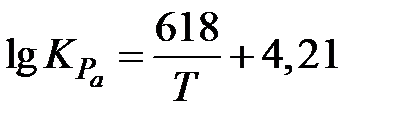 , вычислить константу скорости или коэффициент диффузии газа для безпористого образца при температуре опытов.
, вычислить константу скорости или коэффициент диффузии газа для безпористого образца при температуре опытов.
2.8. В таблице представлены экспериментальные данные по кинетике восстановления оксида меди CuO (α –степень восстановления, %).
| 425 К | t, мин | |||||||||||||||||||
| α,% | ||||||||||||||||||||
| 418 К | t, мин | |||||||||||||||||||
| α,% | ||||||||||||||||||||
| 409 К | t, мин | |||||||||||||||||||
| α,% | 0,03 |
Представить данные графически. Проанализировать. Проверить применимость известных кинетических выражений для описания кинетики топохимических реакций. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.
2.9. В таблице представлены экспериментальные данные по кинетике восстановления водородом железорудных окатышей (rо = 15 мм) при различных температурах (α – степень восстановления, %).
| 873 К | t, мин | |||||
| α,% | 12,8 | 25,3 | 39,5 | 49,3 | 54,7 | |
| 973 К | t, мин | |||||
| α,% | 19,5 | 54,7 | ||||
| 1073 К | t, мин | |||||
| α,% | 29,3 | 49,3 | 95,5 | |||
| 1173 К | t, мин | |||||
| α,% | 96,8 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения α со временем t. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.10. В таблице представлены экспериментальные данные [12] по кинетике восстановления оксида хрома углеродом при 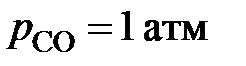 (α – степень восстановления).
(α – степень восстановления).
| 1200оС | t, час | 0,46 | 0,67 | 0,83 | 0,96 | 1,17 | 1,29 | 1,50 | 1,88 | 2,25 | 2,67 |
| α, | 0,128 | 0,211 | 0,324 | 0,452 | 0,641 | 0,777 | 0,852 | 0,890 | 0,905 | 0,912 | |
| 1250оС | t, час | 0,29 | 0,50 | 0,63 | 0,79 | 1,00 | 1,17 | 1,46 | |||
| α, | 0,136 | 0,294 | 0,483 | 0,701 | 0,807 | 0,867 | 0,890 | ||||
| 1300оС | t, час | 0,25 | 0,33 | 0,38 | 0,50 | 0,67 | 0,96 | 1,29 | |||
| α, | 0,241 | 0,475 | 0,663 | 0,799 | 0,875 | 0,905 | 0,920 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.11. В таблице представлены экспериментальные данные [12] по кинетике восстановления актюбинской хромовой руды графитом при 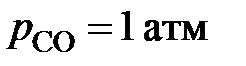 (α – степень восстановления). Руда содержит 63,14% Cr2O3 и 12,12% FeO.
(α – степень восстановления). Руда содержит 63,14% Cr2O3 и 12,12% FeO.
| 1150оС | t, час | 1,00 | 1,50 | 2,00 | 2,50 | 2,95 | 3,45 | 4,00 | 4,50 | 5,00 | 5,35 | 5,70 | |||
| α, | 0,122 | 0,209 | 0,259 | 0,309 | 0,345 | 0,389 | 0,425 | 0,468 | 0,489 | 0,518 | 0,540 | ||||
| 1200оС | t, час | 0,25 | 0,45 | 0,65 | 0,90 | 1,10 | 1,50 | 2,00 | 2,50 | 3,05 | 3,50 | 4,00 | 4,65 | 5,20 | 5,55 |
| α, | 0,058 | 0,101 | 0,187 | 0,295 | 0,381 | 0,475 | 0,561 | 0,604 | 0,669 | 0,698 | 0,734 | 0,770 | 0,799 | 0,813 | |
| 1250оС | t, час | 0,30 | 0,45 | 0,50 | 0,65 | 0,95 | 1,30 | 1,95 | 2,65 | 3,30 | 3,90 | 4,40 | |||
| α, | 0,194 | 0,288 | 0,403 | 0,525 | 0,684 | 0,763 | 0,856 | 0,914 | 0,950 | 0,979 | 0,986 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
2.12. В таблице представлены экспериментальные данные [12] по кинетике восстановления SiO2 графитом (α – степень восстановления).
| 1490оС | t, мин | |||||||
| α, | 0,107 | 0,215 | 0,322 | 0,349 | 0,365 | |||
| 1555оС | t, мин | |||||||
| α, | 0,107 | 0,215 | 0,322 | 0,429 | 0,494 | 0,515 | ||
| 1680оС | t, мин | |||||||
| α, | 0,107 | 0,215 | 0,322 | 0,429 | 0,537 | 0,644 | 0,697 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени восстановления со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.