Известно, что в кристаллах атомы размещены в высшей степени упорядоченно и жестко закреплены в узлах решетки, т.е. они не могут свободно перемещаться. Ограниченная подвижность частиц в кристалле определяет многие специфические особенности твердого тела, в том числе и те, которые проявляются при разложении кристалла.
Особое значение для понимания процесса термического разложения – термолиза кристалла имеет природа химической связи. В качестве наиболее простого примера, рассмотрим особенности процессов термолиза ионных и ковалентных кристаллов.
Термолиз ионных кристаллов идет не до ионов, а до атомов. Основной элементарной стадией термолиза ионных кристаллов является возбуждение электрона и переход его с аниона на катион. Параллельно этому процессу при нагревании ионного кристалла идет образование из ионов молекулярных пар. Следствием этого процесса является плавление кристалла.
Как будет вести себя конкретное твердое тело при нагревании – плавиться или разлагаться (до начала плавления) – зависит от того, насколько быстро скорость каждого из этих процессов изменяется при нагревании, что в конечном итоге зависит от свойств образующих решетку ионов и их основных параметров: радиуса, заряда, строения электронной оболочки.
Кристаллы с ковалентной связью ведут себя при нагревании иначе. Под действием тепла в ковалентных кристаллах может происходить либо образование молекулярных пар и плавление, либо возбуждение электронов межатомных связей до такого состояния, когда происходит диссоциация – разрыв химической связи. Так как распад происходит в конденсированной фазе, то возбужденное состояние может передаваться всему кристаллу и в результате флуктуаций разрыв связи может происходить не там, где был поглощен квант энергии. В ковалентных кристаллах велика вероятность восстановления связей после разрыва, то есть реакция разложения идет обратимо. В случае кристаллов с набором связей (ковалентной, ионной, молекулярной и др.) картина распада будет гораздо сложнее.
На термическое разложение кристаллов большое влияние оказывают различного рода дефекты решетки. Поэтому термолиз кристалла имеет специфические особенности: процесс распада связей локализуется в особых точках кристалла – активных центрах, где более легко происходит разрыв химических связей. Неравноценность отдельных точек поверхности кристалла в энергетическом отношении, искажения решетки, связанное с наличием дефектов, присутствие твердого продукта разложения на границе с исходным веществом во многом определяют особенности развития реакции термолиза – так называемых топохимических реакций.
Термогравиметрия
Термогравиметрический (ТГ) метод заключается в регистрации изменения массы исследуемого образца во времени. При этом температура образца может поддерживаться постоянной - изотермическая ТГ, либо изменяться по заданному режиму (обычно с постоянной скоростью) - динамическая ТГ. Экспериментально полученная кривая зависимости изменения массы от температуры или времени позволяет определить температурный интервал протекания процесса и рассчитать степени превращения исследуемого вещества.
Существует много факторов, влияющих на характер, воспроизводимость и точность результатов ТГ эксперимента: скорость нагревания печи, ее атмосфера, форма и материал держателя образца, масса и теплопроводность образца, размер его частиц, плотность упаковки и др. Их влияние необходимо учитывать в каждом конкретном случае.
Термогравиметрический метод используется при изучении гетерогенных процессов, происходящих с выделением или поглощением газообразных веществ. Он находит широкое применение для изучения процессов в металлургии, лакокрасочной промышленности, производства керамических материалов, пищевой промышленности, а также в минералогии, органической и неорганической химии, химии полимеров, биохимии, геологии и др.
Некоторые трудности в оценке кривой ТГ привели к созданию дифференциальной термогравиметрии (ДТГ), в которой строится кривая зависимости скорости изменения массы (dт/dt) от времени или температуры (рис.1).
Кривая ДТГ позволяет четко фиксировать экстремум скорости изменения массы и, следовательно, определить истинную температуру превращений. Она позволяет также разделить близкие по температурным условиям и даже налагающиеся друг на друга процессы, неразделимые по кривым ТГ. По пикам ДТГ можно обнаружить незначительные изменения массы, а по четко выраженным горизонтальным участкам - границы между двумя эффектами.
Динамическая термогравиметрия широко применяется для исследования кинетики реакций термического разложения.
 |
Считая неизотермическую реакцию в бесконечно малом интервале времени изотермической, ее скорость можно определить выражением:
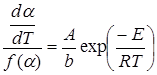 , (5.1)
, (5.1)
где скорость нагрева 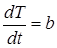 постоянна.
постоянна.
Чтобы использовать уравнение (5.1) для нахождения кинетических параметров из ТГ измерений, существует много методов расчета, которые можно разделить на дифференциальные и интегральные.
Дифференциальные методы основаны на логарифмировании уравнения (5.1):
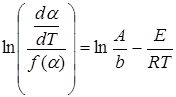 . (5.2)
. (5.2)
Если вид функции 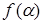 известен, то А и Е можно найти из графика зависимости
известен, то А и Е можно найти из графика зависимости 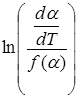 от
от  1/T.
1/T.
В интегральных методах проводят интегрирование уравнения (5.1)
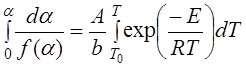 . (5.3)
. (5.3)
Интегрирование функции 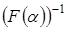 не вызывает затруднений, если известно ее аналитическое выражение. Обычно для реакций термического разложения твердых веществ
не вызывает затруднений, если известно ее аналитическое выражение. Обычно для реакций термического разложения твердых веществ  (n – порядок реакции). Тогда
(n – порядок реакции). Тогда
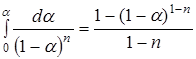 . (5.4)
. (5.4)
Вычисление интеграла 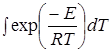 - математическая задача в решении которой исследователи применяют различные приемы. Так Котус и Редферн, используя разложение в ряд, для реакций, порядок которых не известен, получили следующее выражение
- математическая задача в решении которой исследователи применяют различные приемы. Так Котус и Редферн, используя разложение в ряд, для реакций, порядок которых не известен, получили следующее выражение
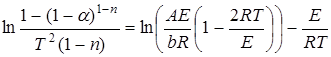 . (5.5)
. (5.5)
График зависимости величины 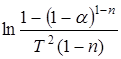 от 1/T при правильном выборе значений n (или
от 1/T при правильном выборе значений n (или 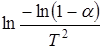 от 1/ T при n =1) имеет вид прямой линии с наклоном, определяемым величиной E/R. Величину
от 1/ T при n =1) имеет вид прямой линии с наклоном, определяемым величиной E/R. Величину 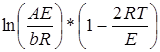 можно считать постоянной для большинства значений Е и интервала температур, в котором протекают реакции.
можно считать постоянной для большинства значений Е и интервала температур, в котором протекают реакции.
Энергию активации можно определить также, используя кривую ДТГ. Исходя из того, что при 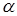 < 0,5 справедливо выражение
< 0,5 справедливо выражение
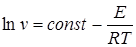 , (5.6)
, (5.6)
где v - скорость изменения массы, можно найти Е из углового коэффициента прямой, построенной в координатах 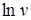 от 1/ Т.
от 1/ Т.
Помимо динамического режима при исследовании фазовых превращений используется квазиизотермический метод. Он используется для исследования кинетики фазовых переходов и стабильности продуктов термолиза.