Являясь двуфункциональным соединением, глюкоза проявляет свойства многоатомного спирта и альдегида (в растворе) - качественная реакция.
1. Горение (а также полное окисление в живом организме): C6H12O6 + 6O2  6CO2 +6H2O
6CO2 +6H2O
а) Как многоатомный спирт при комнатной температуре реагирует с Cu(OH)2, образуя раствор синего цвета.
б) Как альдегид окисляется аммиачным раствором оксида серебра (реакция серебряного зеркала) или гидроксидом меди(II) (качественные реакции):
| HOCH2—(CHOH)4—CHO | + Ag2O 
| HOCH2—(CHOH)4—COOH | + 2Ag |
| глюкоза | глюконовая кислота |
2.
3. HOCH2—(CHOH)4—CHO + Cu(OH)2  HOCH2—(CHOH)4—COOH + Cu2O + 2H2O
HOCH2—(CHOH)4—COOH + Cu2O + 2H2O
4.
в) Как альдегид вступает в реакции присоединения (восстанавливается):
| HOCH2—(CHOH)4—CHO | + H2 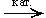
| HOCH2—(CHOH)4—CH2OH |
| глюкоза | сорбит (гексангексаол-1,2,3,4,5,6) |
5.
6. Спиртовое брожение: C6H12O6  2C2H5OH + 2CO2
2C2H5OH + 2CO2 
7. Молочнокислое брожение: C6H12O6  2CH3—CH(OH)—COOH
2CH3—CH(OH)—COOH
Дисахариды
Из дисахаридов наибольшее значение имеет сахароза C12H22O11:

Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы.
Физические свойства: бесцветное кристаллическое вещество, очень хорошо растворимое в воде, сладкое на вкус.
Химические свойства
В растворе сахарозы не происходит раскрытие циклов, поэтому она не обладает свойствами альдегидов.
1. Гидролиз (в кислотной среде):
| C12H22O11 | + H2O | C6H12O6 | + | C6H12O6 |
| сахароза | глюкоза | фруктоза |
2.
3. Являясь многоатомным спиртом, сахароза дает синее окрашивание раствора при реакции с Cu(OH)2.
Полисахариды
Целлюлоза - полимер (—C6H10O5—) n с элементарным звеном, представляющим собой остаток  -глюкозы
-глюкозы
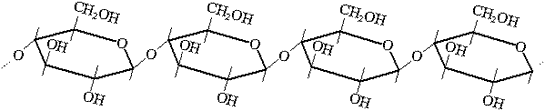
Молекулы целлюлозы имеют линейное строение и большую молекулярную массу. Между молекулами - прочные водородные связи. Целлюлоза нерастворима в воде и других растворителях.
Крахмал - полимер такого же состава, что и целлюлоза, но с элементарным звеном, представляющим собой остаток  -глюкозы
-глюкозы
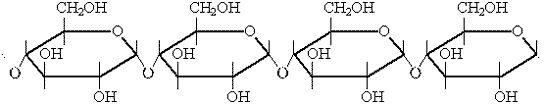
Молекулы крахмала свернуты в спираль, большая часть молекул разветвлена. Молекулярная масса крахмала меньше молекулярной массы целлюлозы. Крахмал - аморфное вещество, нерастворимое в холодной воде, но частично растворимое в горячей.
Химические свойства
1. Горение (практическое значение имеет для целлюлозы): (C6H10O5) n + 6O2  6 n CO2 + 5 n H2O
6 n CO2 + 5 n H2O
2. Гидролиз:
(C6H10O5) n + n H2O n C6H12O6
При гидролизе крахмала образуется  -глюкоза, а при гидролизе целлюлозы -
-глюкоза, а при гидролизе целлюлозы - 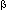 -глюкоза.
-глюкоза.
3. Качественная реакция на крахмал: с йодом возникает синее окрашивание.
4. Термическое разложение целлюлозы без доступа воздуха приводит к образованию метанола, уксусной кислоты, ацетона и др. продуктов.
5. С уксусной и азотной кислотой целлюлоза образует сложные эфиры [C6H7O2(ONO2)3] n и [C6H7O2(OCOCH3)3] n.
Азотсодержащие органические соединения
Амины
Аминами называются производные аммиака NH3, в молекуле которого один или несколько атомов водорода замещены остатками углеводородов.
Аминами можно рассматривать и как производные углеводородов, образованные замещением атомов водорода в углеводородах на группы
- NH2 (первичный амин); - NHR (вторичный амин); - NR'R" (третичный амин).
В зависимости от числа атомов водорода у атома азота, замещенных радикалами, амины называют первичными, вторичными или третичными.
Группа - NH2, входящая в состав первичных аминов, называется аминогруппой. Группа >NH во вторичных аминах называется иминогруппой.
Номенклатура аминов
Обычно амины называют по тем радикалам, которые входят в их молекулу, с прибавлением слова амин.
СН3NH2 – метиламин; (СН3 )2NH – диметиламин; (СН3 )3N – триметиламин.
Ароматические амины имеют особенности номенклатуры.
С6Н5NH2 – фениламин или анилин.
Физические свойства аминов
Первые представители аминов – метиламин, диметиламин, триметиламин – представляют собой при обычной температуре газообразные вещества. Остальные низшие амины – жидкости. Высшие амины – твердые вещества.
Первые представители, подобно аммиаку, растворяются в воде в больших количествах; высшие амины в воде нерастворимы.
Низшие представители обладают сильным запахом. Метиламин CH3NH2 содержится в некоторых растениях, имеет запах аммиака; триметиламин в концентрированном состоянии имеет запах, сходный с запахом аммиака, но в малых концентрациях, с которыми обычно приходится встречаться, имеет очень неприятный запах гнилой рыбы.
Триметиламин (CH3)3N в довольно больших количествах содержится в селедочном рассоле, а также в ряде растений, например, в цветах одного вида боярышника.
Диамины – это группа соединений, которые можно рассматривать как углеводороды, в молекулах которых два атома водорода замещены аминогруппами (NH2).
Путресцин был впервые найден в гное. Он представляет собой тетраметилендиамин:
Н2С – СН2– СН2– СН2
½ ½
NH2 NH2
Кадаверин, гомолог путресцина, был найден в разлагающихся трупах (cadaver – труп), он является пентаметилендиамином:
Н2С – СН2– СН2– СН2– СН2
½ ½ пентаметилендиамин
NH2 NH2
Путресцин и кадаверин образуются из аминокислот при гниении белковых веществ. Оба вещества – сильные основания.
Следующий представитель диаминов – гексаметилендиамин – применя-ется для получения ценного синтетического волокна – найлона.
Н2С – СН2– СН2– СН2– СН2– СН2
½ ½ гексаметилендиамин
NH2NH2
Способы получения аминов
1. Действие аммиака на алкилгалогениды (галогенуглеводороды) - реакция Гофмана.
Начальная реакция: СН3I+NH3= [CH3NH3]I иодметан метиламмонийиодид
Далее реакции идут следующим образом: [CH3NH3]I+NH3DCH3NH2+NH4I метиламин
CH3NH2+ СН3ID[(CH3)2NH2]I диметиламмонийиодид
[(CH3)2NH2]I + NH3 D (CH3)2NH + NH4I диметиламин
(CH3)2NH + СН3I D [(CH3)3NH]I триметиламмонийиодид
[(CH3)3NH]I + NH3 D (CH3)3N + NH4I триметиламин
(CH3)3N + СН3I D [(CH3)4N]I тетраметиламмонийиодид – соль четырехзамещенного аммония
Исходный метиламин может быть получен и следующим образом:
[CH3NH3]I + NaOH = CH3NH2 + NaI + H2O
метиламин
В результате этих реакций получается смесь замещенных солей аммония (на первых стадиях реакцию остановить невозможно).
Подобная реакция позволяет получать так называемые инвертные мыла, мыла, которые используются в кислой среде.
(CH3)3N+ С16Н33ClD[(CH3)3N-С16Н33]Cl
триметилцетиламмоний хлорид
Моющим действием здесь обладает не анион, как в обычных мылах, а катион. Особенность этого мыла в том, что они используются в кислой среде.
Такие мыла не сушат кожу, имеющую, как известно, кислую среду с
рН = 5,5.
В структуру инвертного мыла можно ввести заместитель, проявляющий антимикробную активность. В этом случае синтезируют бактерицидные мыла, используемые в хирургической практике.
2. Восстановление нитросоединений (катализатор никель)
СН3NO2+ 3H2=CH3NH2+ 2Н2О
3. В природных условиях алифатические амины образуются в результате гнилостных бактериальных процессов разложения азотистых веществ – в первую очередь при разложении аминокислот, образующихся из белков. Такие процессы происходят в кишечнике человека и животных.