Разложение реагентов Гриньяра водой также приводит к получению алка-нов. Аналогично ведут себя органические соединения лития.
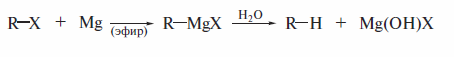
где X= Cl, Br
Реакция Вюрца
Реакция Вюрца (1855 г.) имеет некоторое значение лишь для синтеза симметричных алканов. Эта реакция, однако, представляет исторический интерес
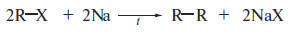
Гидрирование алкенов
Гидрирование алкенов водородом под невысоким давлением в присутствиикатализатора (Pt, Pdили Ni) в настоящее время является важным лабораторным способом получения алканов:
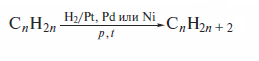
Промышленные способы
Особо следует остановиться на методах промышленного синтеза смесей ал-канов — «синтетического бензина». Один из методов получил название «ожижение угля» и заключается в его каталитической гидрогенизации. В ходе этого процесса твердый каменный уголь тонко измельчают и обрабатывают водородом при высокой температуре:
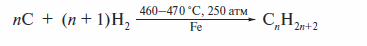
Подругой схеме, гидрированию подвергают оксиды углерода:
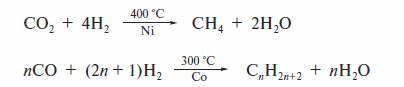
В промышленности реализован и метол Фишера—Тропша (1923 г.). В качестве сырья применяют смесь монооксида углерода и водорода — «синтез-газ ». Источником «синтез-газа» может быть как обработка каменного угля смесью кислорода и водяного пара при высокой температуре, так и переработка природного газа. В настоящее время в ряде стран (Малайзия, Южная Африка) работают заводы по производству моторного топлива (прежде всего, для дизельных двигателей) этим методом.
Физические свойства
Низшие алканы С1—С4 при комнатной температуре газообразны. Средние алканы линейного строения от С5 до С16 являются жидкостями, а высшие— твердыми веществами. Легколетучие жидкие алканы имеют запах бензина. Газообразные алканы и высшие углеводороды не обладают запахом. Как следует из данных табл., температуры кипения алканов монотонно возрастают с увеличением числа СН2 звеньев в молекуле алкана. Этой четкой зависимости не подчиняются разветвленные алканы. Сравним для примера температуры кипения трех изомеров пентана:
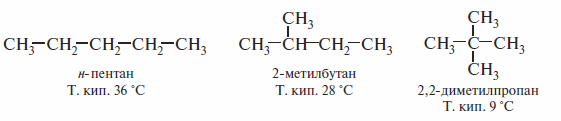
Как видно, разветвление углеродной цепи заметно снижает температуру кипения алкана.Этосвязано с тем,что в разветвленных алканах — 2-метилбутане и особенно 2,2-диметилпропане — поверхности межмолекулярных контактов меньше, чем в линейном н-пентане

Пространственное строение
Межатомные расстояния и валентные углы в молекулах н-алканов не отличаются от стандартных значений. Например, молекула метана представляет собой правильный тетраэдр.
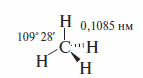
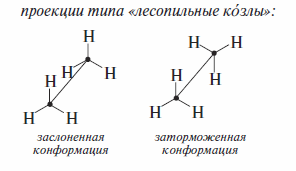
Пространственная структура гомологов метана определяется возможностью свободного вращения фрагментов их молекул, соединенных простыми связями, вокруг этих связей. При таком вращении молекула приобретает определенную геометрию (комформацию). Конформации одного соединения различаются степенью поворота фрагментов молекулы относительно одной или нескольких σ-связей. Например, при повороте метильных групп относительно С—С-связи молекула этана может принимать бесконечное число конформации. Эти конформации различаются по устойчивости. Устойчивые конформации называют конформерами. Конформеры являются конформационными изомерами. В отличие от структурных изомеров они имеют одинаковые структурные формулы, но различаются степенью поворота фрагментов молекулы относительно одной или нескольких σ-связей.
Ниже на примере этана показаны два способа изображения конформа-
цийалканов
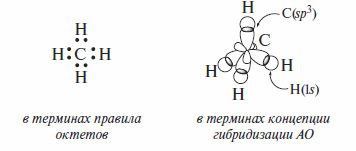
Электронное строение
Электронное строение алканов в терминах правила октетов Льюиса и концепции гибридизации атомных орбиталей иллюстрируется на примере метана.
Алканы обладают весьма жесткими, трудно ионизируемыми и поляризуемыми электронными оболочками, а энергии гетеролитического разрыва С—С и С—Н-связей в них составляют значительные величины. Например, энергия разрыва связи С—Н в метане с образованием метил-катиона CH3+ и гидрид-иона Н- составляет значительную величину:
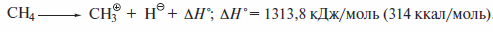
Как следствие алканы устойчивы к действию ионных реагентов. Например, метан без видимых изменений можно пропускать через концентрированную серную кислоту и раствор едкого натра.
Энергии гомолитического разрыва С—С- и С—Н-связей существенно ниже:
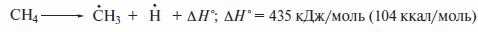
Поэтому алканы склонны, прежде всего, к радикальным реакциям. Эти реакции алканов инициируются нагреванием до высокой температуры или УФ-облучением.
Радикальные реакции
В настоящее время -90% алканов, добываемых из нефти, сжигают в качестве топлива в двигателях внутреннего сгорания и на электростанциях. Это недопустимо много, поскольку алканы весьма склонны к радикальным реакциям и служат ценным сырьем в органическом синтезе.
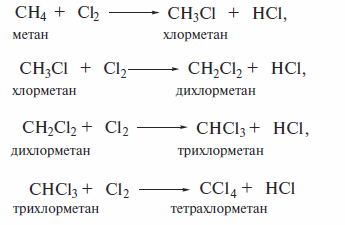
Хлорирование метана
Хлорирование метана является промышленно важным процессом. Последовательное замещение атомов водорода на атомы хлора в его молекуле ведет к получению хлорметана СН3С1, дихлорметана СН2Сl2, трихлорметана (хлороформ) СНС13 и тетрахлорметана (четыреххлористый углерод) СС14. Все четыре продукта находят значительное применение в органическом синтезе, прежде всего (кроме хлорметана) в качестве растворителей.
Общая реакция галогенирования выглядит следующим образом
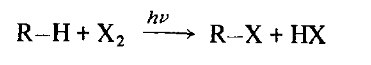
Это справедливо для хлора и брома, но не для йода. „Катализатором" этой реакции служит свет, что показано символом hν. Свет необходим, чтобы обеспечить энергией первую стадию реакции. В темноте реакция не идет.
Рассмотрим теперь механизм галогенирования. Под механизмом понимают последовательность элементарных стадий, через которые проходит реакция. Общепринятым считается следующий механизм галогенирования.

Реакция начинается с того, что под действием света небольшое число молекул галогена диссоциирует на два свободных радикала (стадия а). Эти свободные радикалы, будучи чрезвычайно реакционно-способными, отрывают атомы водорода от молекул алканов R—Н. При этом образуется алкильный свободный радикал R. (стадия б). Этот новый свободный радикал также очень легко вступает в реакции и, столкнувшись с молекулой галогена, реагирует с ней, образуя галогеналкан и снова свободный радикал Х.(стадия в). Этот радикал начинает новую цепочку превращений. Процесс продолжается до тех пор, пока не будут израсходованы реагенты или пока он не будет прерван в результате одной из реакций г)-е), в которых не образуется свободных радикалов. Однако эти последние реакции не имеют большого значения, так как в них вступает пренебрежимо малое число молекул. Для реакции бромирования этана можно записать:
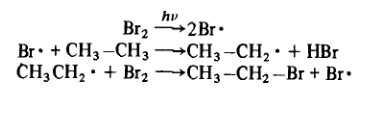
В молекуле этана все атомы водорода эквивалентны все они первичные и находятся на конце цепи. В более сложных случаях, например, в молекуле 2-метилбутана имеется несколько типов атомов водорода:
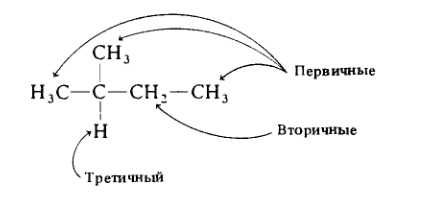
Здесь имеется два типа первичных атомов водорода (на концах цепи), вторичные водородные атомы (при атоме углерода в середине цепи, связанном с двумя другими углеродными атомами) и, наконец, третичный атом водорода (при атоме углерода в месте разветвления, связанном с тремя другими углеродными атомами).
При галогенировании алканов легче всего замещаются на атом галогена третичные атомы водорода, труднее замещаются вторичные, и еще труднее первичные водородные атомы. Особенно велика разница в реакционной способности первичных, вторичных и третичных атомов водорода в реакции бромирования. Например 2-метилбутан бромирует-ся на свету с образованием почти исключительно третичного бромида:
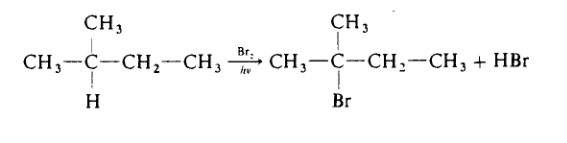
Нитрование алканов
Нитрование алканов впервые провел М.И. Коновалов действием 10—20%-й азотной кислоты при 120— 150 °С (реакция Коновалова, 1888 г.). В настоящее время известно несколько схем промышленного нитрования алканов: в жилкой фазе при 100—150 °С и в газовой фазе при 350—500 °С. Концентрация азотной кислоты изменяется в пределах 40—70%.
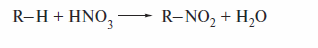
Реакция идет по свободнорадикальному механизму:
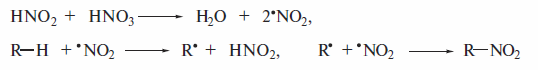 В В более концентрированной азотной кислоте (60—70%-й) источником радикала .NO2 может быть и разложение молекулы HNO3
В В более концентрированной азотной кислоте (60—70%-й) источником радикала .NO2 может быть и разложение молекулы HNO3
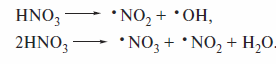
Алканы нитруют также в жидкой или газовой фазе с применением тетра-оксида азота N2O4.
В отличие от галогенирования свободнорадикальное нитрование не протекает по цепному механизму: в стадии образования нитросоединения не возобновляется какой-либо из промежуточных свободных радикалов. Вместе с тем, как и в случае других свободнорадикальных реакций алканов, состав продуктов их нитрования также определяется способностью различных С—Н-связей к гемолитическому разрыву. Однако в отличие от реакций галогенирования в ходе реакций нитрования часто наблюдается разрыв и С—С-связей (деструктивное нитрование).
Сульфохлорирование
Сульфохлорированиеалканов при УФ-облучении, при комнатной температуре, протекает как цепной радикальный процесс (реакция Рида, 1936 г.). В качестве продуктов при этом получают хлорангидридыалкансульфокислот
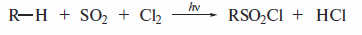
Ниже показана последовательность элементарных стадий:
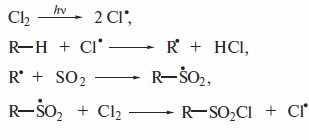
Присутствие атомарного хлора в реакционной смеси неизбежно должно вести к конкуренции сульфохлорирования и хлорирования. Чтобы подавить хлорирование, реакцию проводят в присутствии большого избытка SO2(Еше одной особенностью реакции сульфохлорирования является тот факт, что при наличии в молекуле углеводорода первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном углеродном атоме:
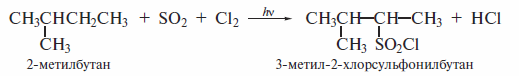
Предполагают, что причиной такой особенности реакции является пространственная затрудненность подхода объемистого реагента к третичному атому углерода.
Окисление алканов
Окисление алканов также имеет радикальный механизм и может быть полным (с образованием диоксида углерода и воды)
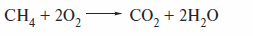
или частичным (с образованием СО или элементного углерода)
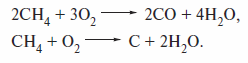
Примером полного окисления алканов является использование их в качестве топлива на тепловых электростанциях и применение бензиновых фракций в двигателях внутреннего сгорания. В последнем случае используют разветвленные алканы, поскольку линейные алканы в двигателях взрываются (детонируют).
Свойства бензинов характеризуют октановым числом (о.ч.). При этом принимают, что 2,2,4-триметилпентан (изооктан) — один из изомеров октана — имеет октановое число, равное 100, а н-гептан — октановое число, равное нулю.
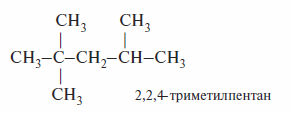
Октановое число любого бензина равно содержанию (в об. %) триметил-пентана в смеси триметилпентан—н-гептан, которая обладает одинаковыми детонационными свойствами с испытуемым бензином.
Топливо для двигателей внутреннего сгорания производят ректификацией нефти. При этом получают следующие основные фракции:

В качестве топлива для автомобилей используют средние фракции, а нелетучий остаток перерабатывают в смазочные масла, смазки, парафин, асфальт.
Окисление метана наблюдается и при действии воды в присутствии катализатора при высокой температуре:
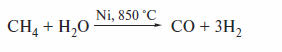
Процесс сопровождается получением синтез-газа — сырья для синтеза ал-канов по Фишеру—Тропшу и значительного числа важнейших органических соединений.
Термолиз
Термолиз алканов также имеет радикальную природу, но протекает с образованием различных продуктов в зависимости от условий.
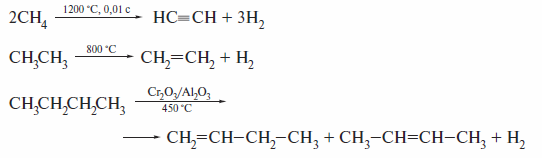
К термическим реакциям алканов относят также крекинг и риформинг. Так называют химические процессы, применяемые в промышленности для переработки нефтяного сырья. Их целью является повышение выхода и качества бензиновых фракций, пригодных для использования в качестве моторного топлива.
Крекингу подвергают высококипящие нефтяные остатки, получаемые при перегонке нефти. В ходе крекинга более высокомолекулярные алканыпревращаются в низкомолекулярные. Это достигается, в частности, применением очень высокой температуры — до 700—900 °С (термический крекинг).
Недостатком термического крекинга является то, что его продукты не содержат значительных количеств разветвленных алканов, вследствие чего с его помощью не удается получать моторное топливо с октановым числом выше 65—70. Лучших результатов добиваются в схемах каталитического крекинга. Его проводят с применением алюмосиликатного катализатора (типа цеолит Y) и при более умеренных температурах (400—450 °С).
Еще более эффективным процессом получения моторного топлива с максимальным значением октанового числа является риформинг. Этотпроцесс предназначен для превращения средних линейных алканов в циклоалканы и далее в ароматические углеводороды:
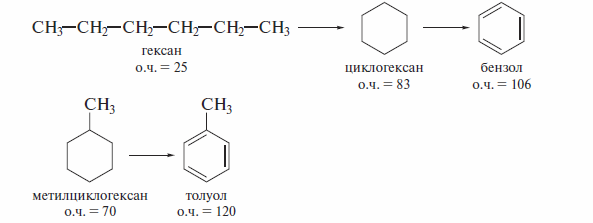
В отличие от каталитического крекинга, который проводят на катализаторах кислотного типа, в процессах риформинга используют дегидрирующие гетерогенные катализаторы. Если в процессе риформинга применяют платинорениевые катализаторы, такой процесс называют платформингом.
Термокаталитические методы переработки нефтяных фракций лежат в основе производства углеводородного сырья для промышленности основного органического синтеза.