ОРГАНИЗМА
Понятия. В ходе алгезиметрии – выведения зависимости между силой потенциально болевого раздражителя, действующего на человека, и характером вызываемой у него субъективной реакции показано, что ощущения боли впервые обнаруживаются при некоторой минимальной силе раздражителя, получившей название болевого порога. Сила раздражителя, при которой испытуемый просит прекратить его действие из-за невыносимой боли, получила название порога болеустойчивости.
Детальное изучение вопроса о способности испытуемых переносить болевые воздействия в разных вариантах опытов по алгезиметрии, психологические, клинические наблюдения представили убедительные доказательства того, что при некоторых изменениях общего состояния испытуемых у них наблюдается варьирование болевых порогов, а также порогов болеустойчивости. В ряде случаев это – гипералгезия (повышение болевой чувствительности), но часто это – гипоалгезия (понижение болевой чуствительности) вплоть до аналгезии, т. е. полной нечувствительности к боли.
Исследования, проведенные на животных и человеке с целью уточнения функциональных особенностей различных подкорковых образований ЦНС при электрической стимуляции ядер промежуточного, среднего, продолговатого мозга показали, что часто следствием стимуляции подкорковых ядер была достоверная гипоалгелзия или аналгезия.
Концепция об обезболивающей системе организма. Собранные воедино факты позволили обосновать предположения, что активность структур, относящихся к болевому анализатору, может изменяться некими центральными механизмами, обладающими способностью редуцировать болевые импульсации, перемещающиеся в ЦНС, вплоть до низведения их на уровень, при котором возникают состояния гипоалгезии и аналгезии. Соответствующий комплекс механизмов получил название эндогенной антиноцицептивной (обезболивающей) системы.
В течение последних 35 лет накопилось большое количество данных, продемонстрировавших актуальность нового направления в физиологии, связанного с рассмотрением вопросов функционирования антиноцицепивной системы. Дополнительным толчком к изучению частных принципов ее работы, внутренней архитектоники явилось открытие в ЦНС опиатных рецепторов – участков связывания препаратов опия. Было известно, что препараты опия (морфин, его производные), взаимодействуя с опиатными рецепторами, вызывают состояние аналгезии. Открытие опиатных рецепторов интенсифицировало поиск эндогенных, т. е. естественных, аналогов морфина, вырабатываемых клетками самого организма. В конечном итоге эндогенные опиоиды были обнаружены. Ими оказались пептиды – продукты протеолиза гипофизарного гормона бета-липотропина, получившие название эндорфинов (альфа, бета, гамма), энкефалинов (метионин-энкефалин, лейцин-энкефалин), динорфинов. Анализ свойств эндорфинов, энкефалинов, динорфинов показал, что они, как и морфин, угнетают действие веществ (простагландины, брадикинин и др.), вызывающих боль на уровне ноцицепторов, уменьшают возбудимость и проводимость проводников болевой импульсации, угнетают вызванную реакцию нейронов, находящихся в составе цепей, опосредующих передачу болевой импульсации. Наряду с констатацией уникальных свойств эндогенных опиоидов, получением доказательств того, что они выделяются в окончаниях пептидергических нейронов, в разных экспериментах была установлена причастность к антиноцицептивным механизмам серотонинергических, норадренергических, дофаминергических нейронов, а также нейротензина, ангиотензина, окситоцина, холецистокинина, других биологически активных веществ. Все вместе взятое подтвердило правильность исходных гипотез об антиноцицептивной системе как совокупности гетерогенных механизмов ЦНС, фактически выступающих составной частью ноцицептивной системы организма, т. е. системы болевого анализатора.
Стволовой уровень антиноцицептивной системы. В первую очередь к стволовым механизмам антиноцицептивной системы относятся механизмы центрального серого околоводопроводного вещества (ЦСОВ) и ядер шва (ЯШ), образующие единый функциональный блок. Доказано, что изолированная электрическая стимуляция ЦСОВ–ЯШ блокирует прохождение болевой импульсации на уровне релейных нейронов ядер задних рогов спинного мозга, а также релейных нейронов сенсорных ядер тройничного нерва.
Специфические влияния ЦСОВ-ЯШ на ядра–мишени реализуются нисходящими волокнами, большинство из которых в своих окончаниях выделяют серотонин (СТ), вызывающий ТПСП на релейных нейронах и ВПСП на энкефалинергических вставочных нейронах ядер–мишеней. Вовлечение энкефалинергических нейронов, располагающихся в непосредственной близости от релейных, включает дополнительные механизмы пост– и пресинаптического торможения, что приводит к существенному удлинению тормозного состояния релейных нейронов в сравнении с тем, что обеспечивается серотонином.
Отметим, что пусковые угнетающие влияния ЦСОВ-ЯШ на передачу болевой импульсации не сводятся исключительно к серотонинергическим механизмам, т. к. около 15% нейронов ЦСОВ-ЯШ в окончаниях своих аксонов выделяют не серотонин, а энкефалины (Эн), вещество П (ВП), ацетилхолин (АХ), другие вещества, очевидно выполняющих функции модуляторов синаптической передачи в нейронных объединениях ядер–мишеней.
Кроме ЦСОВ-ЯШ в состав антиноцицептивных механизмов стволового уровня входят крупноклеточное, парагигантоклеточное ядра ретикулярной формации продолговатого мозга и голубое пятно. Все они морфологически связаны между собой, с комплексом ЦСОВ-ЯШ прямыми и обратными связями.
Необходимо подчеркнуть, что хотя аксоны ядер ретикулярной формации, голубого пятна обнаруживаются в задних рогах спинного мозга, наибольшая их плотность наблюдается в местах расположения сенсорных ядер тройничного нерва. Показано, что стимуляция парагигантоклеточного ядра ретикулярной формации, стимуляция голубого пятна подавляют ответы нейронов тройничных сенсорных ядер, вызванных болевыми стимулами. Механизмы подавления ответов – пост– и пресинаптические за счет энкефалинергических (со стороны аксонов парагигантоклеточного ядра) и норадренергических (со стороны аксонов голубого пятна) влияний на рецепторы соматической мембраны нейронов, а также рецепторы мембраны пресинаптических С–волокон.
Особенностью норадренергических антиноцицептивных механизмов ствола мозга является привнесение большей избирательности в процесс угнетения передачи болевой импульсации в сравнении с качеством угнетения за счет ЦСОВ-ЯШ. Последние блокируют импульсации не только болевого, но и неболевого характера. Каким образом в обычных условиях активируются стволовые механизмы антиноцицептивной системы, какова их функциональная роль?

Рис. Схема базовых механизмов стволового уровня антиноцицептивной системы (описание в тексте).
ППН – 1-й переключательный нейрон; ВП – вещество П; Эн – энкефалинергический нейрон; С – серотонин; На – норадреналин. ГРЯ – гигантоклеточное ядро; ЦСОВ – центральное серое околоводопроводное вещество; ЯШ – ядра шва; ГП – голубое пятно; ЯРФ – ядра ретикулярной формации продолговатого мозга.
Одна из гипотез приспособительную активность стволовых механизмов антиноцицепции связывает с управлением интенсивности восходящего болевого потока в условиях усиления его на входе в ЦНС. Так, в случаях возрастания силы болевого воздействия усиливающийся поток импульсаций по волокнам спинно-таламических, тригемино-таламичесих трактов активирует за счет коллатералей нейроны гигантоклееточного ядра ретикулярной формации. Последнее возбуждает почти весь комплекс антиноцицептивных механизмов ствола мозга. В итоге – включаются нисходящие механизмы ограничения поступления избыточной болевой импульсации в ЦНС. Фактически в данной ситуации мы сталкиваемся с проявлением модуляции физиологического процесса отрицательной обратной связью (Р. Шмидт).
Гипоталамический уровень антиноцицептивной системы – с одной стороны функционирует самостоятельно, с другой – выступает как надстройка, контролирующая и регулирующая антиноцицептивные механизмы стволового уровня за счет связей гипоталамических нейронов разной ядерной принадлежности и разной нейрохимической специфичности. Среди них идентифицированы нейроны, в окончаниях аксонов которых выделяются энкефалины, бета-эндорфин, норадреналин, дофамин.
Известно, что многие гипоталамические ядра входят в зоны, стимуляция которых вызывает эмоционально окрашенные состояния – положительные и отрицательные (Дж. Одлс, Ю. А. Макаренко).
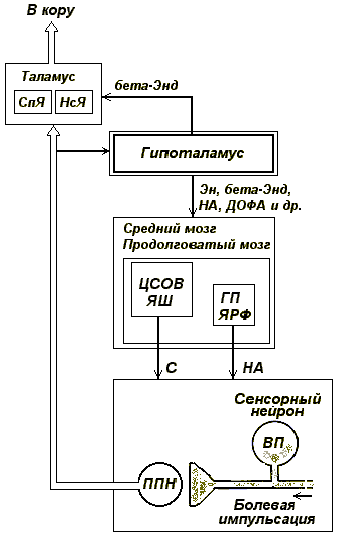
Рис. Схема базовых механизмов гипоталамического уровня антиноцицептивной системы (описание в тексте).
ППН – 1-й переключательный нейрон; ВП – вещество П; Эн – энкефалин; С – серотонин; На – норадреналин. ЦСОВ – центральное серое околоводопроводное вещество; ЯШ – ядра шва; ГП – голубое пятно; ЯРФ – ядра ретикулярной формации продолговатого мозга; СпЯ – специфические ядра таламуса; НсЯ – неспецифические ядра таламуса
Как оказалось, раздражение зон положительного подкрепления (дорзомедиальное ядро гипоталамуса) вызывает гипоалгезию – частично, за счет энкефалинергических влияний, повышающих активность антиноциптивных механизмов стволового уровня, частично за счет бета-эндорфинергических влияний, угнетающих передачу болевой импульсации через неспецифические ядра таламуса.
Раздражение зон отрицательного подкрепления (вентромедиальное ядро), как и натуральные состояния агрессии, тоски, страха (стрессовые состояния) также сопровождаются гипоалгезией, в ряде случаев – аналгезией. Показано, что применительно к этим ситуациям первостепенная роль в возникновении состояний гипоалгезии, аналгезии отводится активации норадренергических и дофаминергических нейронов. Интересно, что при стрессе выброс в кровь из передней доли гипофиза АКТГ, сопровождается параллельным выбросом также из передней доли гипофиза бета-эндорфина (Ф. Блюм). Бета-эндорфин, реализуя свои влияния гуморально, оказывает угнетающее влияние на активность ноцицепторов, а также нейронов большинства каналов передачи болевой импульсации в ЦНС, внося дополнительный вклад в поддержание гипоалгезии или аналгезии гипоталамического происхождения при стрессе.
Корковый уровень антиноцицептивной системы. Нисходящие волокна коркового контроля болевой чувствительности, направляющиеся к задним рогам спинного мозга, сенсорным ядрам тройничного нерва,берут начало в различных областях моторной, орбитальной коры, в полях С1, С2, при этом наибольшее число волокон составляют аксоны нейронов, локализованных в поле С2.
В целом кортикофугальные влияния на ядра-мишени проявляют себя по-разному. Они могут оказывать возбуждающие моносинаптические влияния на выходные нейроны ядер-мишеней, однако преобладают пост- и пресинаптические тормозные влияния на эти нейроны, в особенности на нейроны, контактирующие с афферентами С–типа. Помимо прямых влияний на ядра спинного мозга, тройничного нерва, поле С2 контролирует их активность опосредованно, видоизменяя активность стволового комплекса антиноцицептивной системы.
Важно отметить специфическую роль моторных и соматосенсорных полей коры мозга в контроле проведения афферентных импульсаций через таламус. В экспериментах, проведенных многими исследователями, было установлено, что пропускная активность таламических ядер всегда организуется с учетом функционального состояния организма и направлена на изменение «удельного веса» определенных импульсаций, проходящих в кору (П. Г. Костюк, Т. Цумото, С. Накамура, К. Ивама). Например, в условиях обычного состояния организма под влиянием фазной активности кортикальных нейронов приоритетно пропускается импульсация от кожных неболевых рецепторов. При выполнении моторных движений преимущественно пропускается кинестетическая импульсация, при действии болевых раздражителей на организм – из общего потока возбуждений на уровне таламуса начинают дозировано выделяться болевые импульсации, направляющиеся в ассоциативные, орбито-фронтальные поля, поля С1, С2 – для всесторонней оценки и анализа. Физиологические механизмы выделения возбуждений той или иной модальности, в частности, болевой – пост- и пресинаптические виды торможения, реализуемые вставочными нейронами, контактирующие с кортикальными нейронами.
Корковые влияния, регламентирующие прохождение болевых импульсаций в ЦНС, проявляют себя в гипоталамусе, а также в связанных с ним функционально образованиях лимбического мозга, ретикулярной формации, в спинном мозге.
Ведущая роль в обеспечении кортико-гипоталамических влияний отводится нейронам лобной коры. Характер корковых влияний на гипоталамус – модулирующий, имеющий результатом в одних случаях усиление активности гипоталамических ядер, участвующих в обработке болевых импульсаций, в других – их угнетение. Знак влияний зависит от многих факторов, вытекающих, в основном, из складывающейся наличной ситуации в отношении целей и задач подготавливаемых корой поведенческих актов. Примером чисто корковой коррекции реагирования организма на болевой раздражитель за счет первоочередного изменения гипоталамической активности являются опыты, проведенные в лаборатории И. П. Павлова, по выработке пищевого условного рефлекса у собак на болевой раздражитель в качестве условного сигнала. Как оказалось, реакция на боль у собаки в виде генерализованных движений, учащенного дыхания, голосовых реакций и т. п., свидетельствующих об очевидном проявлении эмоционального переживания боли в результате вовлечения в процесс гипоталамических эмоциогенных центров, наблюдалась только в первых предъявлениях условного болевого сигнала. В дальнейшем эта реакция исчезала, а в ответ на предъявление условного болевого сигнала у собаки отмечалось выделение слюны. Ч. Шеррингтон, когда ему продемонстрировали данный опыт, сказал: «Теперь я понимаю психологию мучеников».
В заключение главы отметим, что субъективное восприятие боли человеком не определяется одной лишь силой экзогенного или эндогенного болевого воздействия. Во многом оно зависит от баланса активностей ноцицептивной и антиноцицептивной систем организма. Повышение функциональной активности ноцицептивной системы или снижение активности антиноцицептивной системы приводит к увеличению болевой чувствительности. Наоборот, снижение активности ноцицептивной системы при одновременном повышении активности антиноцицептивной системы приводит к снижению болевой чувствительности. Подобного рода сочетанные изменения тонической активности двух систем имеют приспособительное значение. Так, в случае преодоления человеком кризисных ситуаций адаптивным фактором выступает аналгезия, помогая ему поддержать избыточный уровень физической активности, не обращая внимание на объективные ограничения, связанные с травмами или даже с серьезными ранениями. В других случаях адаптивным фактором может быть гипералгезия, позволяя человеку, например, в процессе ожидания воздействия на него губительных раздражителей, быстро выделить начальные, ранние проявления воздействия таких раздражителей, что повышает вероятность успешного уклонения человека от соприкосновения с этими раздражителями.
Физиологические механизмы обезболивания, применяемые в клинической практике.
Местная анестезия реализуется за счет блокады проведения болевой импульсации на уровне ноцицепторов, периферических нервных волокон. Разновидностью ее является – местная инфильтрационная анестезия. При этом ткань, (например, мышца) инфильтрируется анестезирующим веществом. В случае проводниковой анестезии анестезирующее вещество подводят в область расположения того или иного нервного ствола.
Продолжительность местной анестезии зависит от вида анестетика, обычно длится 20-60 мин, используется при вмешательствах малого объема и продолжительности (удаление зуба). Местные анестетики (новокаин) блокируют реакции воротного механизма натриевых потенциал-управляемых каналов нервных волокон на изменения мембранного потенциала. Это приводит к тому, что распространяющиеся потенциалы действия в зоне обработанного анестетиком волокна оказываются неспособными открыть натриевые каналы и запустить регенеративную деполяризацию. Именно поэтому в обработанном участке нервные волокна временно теряют возбудимость и проводимость.

Рис. Схема возможного механизма акупунктурной аналгезии (По Б. Померанцу, с изменениями). Описание в тексте. БАТ – биологически активная точка; ЦСОВ-ЯШ – ядра центрального серого околоводопроводного вещества, ядра шва.
Общая анестезия – используется при выполнении сложных, длительных оперативных вмешательств. Достигается применением особых наркотических препаратов, которые вводятся ингаляционно, внутривенно и которые прерывают проведение болевой импульсации преимущественно на подкорковом уровне.
В последние годы для борьбы с болью широкое распространение получили нетрадиционные методы обезболивания. Среди них отметим метод механического воздействия на биологически активные точки тела (скопление сенсорных рецепторов) с помощью специальных игл – иглоукалывание, или акупунктура. Разновидностью акупунктуры является электроакупунктура – метод электрического воздействия на биологически активные точки. В обоих случаях стимуляция биологически активных точек в течение 20-30 мин вызывает эффект аналгезии.
Физиологический механизм акупунктурной аналгезии объясняется рефлекторным выбросом в кровь из гипофиза во время проведения сеанса иглоукалывания эндорфинов (рис.). В последующем эндорфины возвращаются в мозг, связываются с опиатными рецепторы, нарушая синаптическую передачу болевой импульсации в ЦНС (Б. Померанц). Подтверждением данной гипотезы являются опыты с удалением гипофиза у крыс. Как выяснилось, после гипофизэктомии акупунктурная аналгезия не наступает.