СОДЕРЖАНИЕ
Введение...................................................................................................................................... 3
1 Высшие жирные кислоты. Основные характеристики....................................................... 4
2Производство вжс..................................................................................................................... 7
3Производство высших жирных спиртов гидрированием жирных кислот и их эфиров...8
4Список использованной литературы..................................................................................... 14
Введение
Жирные кислоты - это алифатические карбоновые кислоты. Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Число атомов углерода в них может достигать 22 - 24. Основная масса жирных кислот, входящих в организм человека и животных, имеют четное число атомов углерода, что обусловлено особенностями их синтеза. Они, как правило, имеют неразветвленную углеродную цепь. Жирные кислоты могут быть насыщенными (только с одинарными связями между атомами углерода), ненасыщенными (с одной двойной связью между атомами углерода) и полиненасыщенными (с двумя и более двойными связями, находящимися, как правило, через CH2-группу). Они различаются по количеству углеродных атомов в цепи, а также в случае ненасыщенных кислот, по положению, конфигурации (как правило цис-) и количеству двойных связей. Жирные кислоты можно условно поделить на низшие (до семи атомов углерода), средние (восемь - двенадцать атомов углерода) и высшие (более двенадцати атомов углерода). Исходя из исторического названия, данные вещества должны быть компонентами жиров. На сегодня это не так, термин жирные кислоты подразумевают под собой более широкую группу веществ.
Насыщенные жирные кислоты (стеариновая C17H35COOH, пальмитиновая C15H31COOH), не имеющие в своей структуре кратных углерод-углеродных связей. Ненасыщенные - имеющие в своей структуре двойные или тройные углерод-углеродные связи, причем тройные связи встречаются, крайне редко. Например, пальмитолеиновая (C15H29COOH, 1 двойная связь), олеиновая (C17H33COOH, 1 двойная связь), линолевая (C17H31COOH, 2 двойные связи), линоленовая (C17H29COOH, 3 двойные связи), арахидоновая (C19H31COOH, 4 двойные связи, встречается реже).
В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая.
Ненасыщенные жирные кислоты, в свою очередь, делятся на моноеновые, т.е. содержащие 1 кратную связь, и полиеновые содержащие несколько кратных связей (диеновые, триеновые и т.д.). Все природные ненасыщенные жирные кислоты имеют стереохимическую цис-конфигурацию. Природные ненасыщенные жирные кислоты обычно имеют тривиальные названия: олеиновая, пальмитолеиновая, линолевая, линоленовая, арахидоновая и др. кислоты. Однако иногда удобнее пользоваться систематическими их наименованиями, отражающими особенности структуры каждого соединения. Так, например, олеиновая кислота называется цис-9-октадеценовой кислотой: из названия следует, что эта кислота имеет 18 атомов углерода, она содержит одну двойную связь, начинающуюся от девятого атома углерода цепи, и имеет цис-стереохимическую конфигурацию относительно этой двойной связи. Линолевая кислота по систематической номенклатуре называется как полностью цис-9, 12-октадекадиеновая кислота, а арахидоновая - полностью цис-5, 8,11,14-эйкозатетраеновая (углеводород эйкозан содержит 20 атомов углерода). кислота химический линолевый
Число атомов углерода в натуральных жирных кислотах в основном чётное, что обусловлено их биосинтезом с участием кофермента А.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) - непредельными.
Жиры растворимы в органических растворителях и нерастворимы в воде.
Гидролиз, или омыление, жиров происходит под действием воды (обратимо) или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами.
Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, при этом жиры из жидких превращаются в твердые.
Мыла - это соли высших карбоновых кислот. В химическом отношении основным компонентом мыла являются смесь растворимых солей высших жирных кислот.
Соли высших жирных (С 8-С 18) нафтеновых и смоляных кислот, одни из основные моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называют щелочными мылами, водонерастворимые соли, содержащие металлы II, III и др. гр. (например, Са, Mg, Ni, Mn, Al, Co, Pb и др.) - металлическими.
Обычно это натриевые, реже - калиевые и аммониевые соли таких кислот как стеариновая, пальмитиновая, миристиновая, лауриновая и олеиновая.
По способу получения мыла делят на клеевые, ядровые и пилированные, по целевому назначению - на хозяйственные, туалетные, технические, специальные и медицинские, по товарной форме - на твердые, жидкие и пастообразные.
Дополнительно в составе мыла могут быть и другие вещества, обладающие моющим действием, а также ароматизаторы и красители.
Современные жидкие мыла представляют собой водные растворы синтетических ионных или неионогенных поверхностно-активных веществ с добавлением консервантов, отдушек, красителей, солей для контроля вязкости, добавок для связывания ионов кальция и магния и т. д.
обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли - жидкие мыла. Мыла получаются при гидролизе жиров в присутствии щелочей.
Отсюда реакция, обратная этерификации, получила название реакции омыления. Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла. Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров - синтетические карбоновые жирные кислоты с большей молекулярной массой. Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21атома углерода, - хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов - солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями.
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья - растительных масел и жиров.
Натриевые и калиевые соли высших жирных кислот являются эффективными ПАВ и используются в качестве мыл. В пищевой промышленности жирные кислоты зарегистрированы в качестве пищевой добавки E570, как стабилизаторы пены, глазирователи и пеногасители.
Высшие жирные кислоты. Основные характеристики
Высшие жирные кислоты –
это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- имеют неразветвленную структуру с четным числом атомов углерода от С2 до С80, но чаще всего встречаются кислоты состава С16, С18 и С20;
- ненасыщенные кислоты, как правило, содержат двойную связь в положении 9;
- если двойных связей несколько, то они разделены группой СН2;
- двойные связи в ненасыщенных кислотах имеют цис -конфигурацию.
Получают натуральные высшие жирные кислоты из жиров и масел. В промышленности используют преимущественно высокотемпературный (200-225 oС) гидролиз под давлением (~ 2,50 МПа), реже - кислотный гидролиз в присутствии контакта Петрова. В лабораторных условиях высшие жирные кислоты синтезируют кислотным гидролизом в присутствии реактива Твитчеля (смесь олеиновой и серной кислот с бензолом), ферментативным (липазным) гидролизом, омылением растворами гидроксидов металлов I группы с последующим разложением образовавшихся солей (мыл) водными растворами H2SO4 или НСl.

Табл. 1.-СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ВЫСШИХ ЖИРНЫХ КИСЛОТ
* Вязкости каприловой, лауриновой и ммристнновой кислот соотв. 5,83 МПа*с (20°С), 6,877 МПа*с (20°С) и 5,06 МПа*с (75 oС).

Табл. 2-ХАРАКТЕРИСТИКА ФРАКЦИЙ* СИНТЕТИЧЕСКИХ ЖИРНЫХ КИСЛОТ
* Температуры застывания: 25-35oС (фракция С10-С16), 45-51 °С (С17-С20).
Синтетические высшие жирные кислоты, получаемые в промышленности из нефтехимического сырья, представляют собой, как правило, смеси насыщенных, преимущественно монокарбоновых кислот нормального и изостроения с четным и нечетным числом атомов углерода в молекуле, содержащие примеси дикарбоновых, гидрокси- и кетокарбоновых кислот и др. соединений. Основной способ синтеза - окисление парафиновкислородом воздуха при 105-120°С и атмосферном давлении (катализатор - соединения Мn, например MnSO4, MnO2, КМnО4). Степень превращения парафина 30-35%. Продукты окисления нейтрализуют при 90-95oС 20%-ным раствором Na2CO3 и омыляют 30%-ным раствором NaOH; из полученных мыл кислоты выделяют обработкой H2SO4 и фракционируют. Неомыляемые продукты удаляют термической обработкой в автоклаве при 160-180°С и 2,0 МПа, а затем в термической печи при 320-340°С. Недостатки процесса: невысокий выход целевой фракции С10-С20 (около 50% на сырье), низкое качество кислот, обусловленное присутствием до 3% побочных продуктов (дикарбоновых, кето- и гидроксикарбоновых кислот и др.), большой объем сточных вод (до 8 м3 на 1 т кислот), загрязненных Na2SO4 и низкомолекулярными кислотами. В СССР получаемые этим способом высшие жирные кислоты выпускают под названием «синтетические жирные кислоты" (СЖК). Предусмотренные к выпуску фракции указаны в табл. 2.
2-Этилгексановую кислоту и фракцию кислот С8-С10 получают окислением соответствующих альдегидов оксосинтеза кислородом или кислородсодержащим газом при 40-90°С и 0,1-1,0 МПа (катализаторы - металлы I, II или VIII группы). Высшие жирные кислоты фракций С12-С15, С16-С18 синтезируют окислением оксоспиртов, например в водных щелочных растворах при 70-120°С в присутствии металлов платиновой группы или расплавленной щелочью при 170-280°С и давлении, необходимом для поддержания продуктов в жидкой фазе. Получаемые кислоты содержат меньше побочных продуктов, чем кислоты, синтезируемые из парафинов.
Практическую значимость приобретают методы синтеза высших жирных кислот из олефинов в присутствии Со2(СО)8: гидрокарбоксилирование при 145-165 °С и 5-30 МПа: RCH=СН2 + СО + Н2О -> RCH2CH2COOH; гидрокарбоалкоксилирование при 165-175 °С и 5-15 МПа с последующим гидролизомобразующегося эфира:
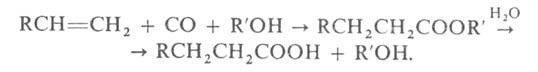
Преимущества процессов: малостадийность, высокие выходы кислот; недостатки: довольно жесткие условия, образование большого количества (до 50%) кислот изостроения.
Высшие жирные кислоты синтезируют также гидрокарбоксилированием олефинов в присутствии кислот, например H2SO4, HF, BF3, при 50-100°С, давлении5-15 МПа (процесс Коха). При использовании сокатализаторов (карбонилов Си и Ag) реакцию можно вести при 0-30°С и 0,1 МПа. Получают в основном смеси кислот изостроения. Они отличаются низкими температурами плавления и кипения, высокой вязкостью, хорошей растворимостью. Недостаток метода - высокоагрессивная среда.
Высшие жирные кислоты (см. табл. 2) применяют в производстве: пластичных смазок (фракции С5—С6, С7—С9, С20 и выше); синтетических спиртов (С7—С9, С9—С10, С10—С16); лакокрасочных материалов - для улучшения смачиваемости и диспергирования пигментов, предотвращения их оседания, изменения вязкости красок (С8—С18); латексов и каучуков - как эмульгаторы при полимеризации бутадиенсодержащих мономеров (С10—С13, С12—C16); неионогенных ПАВ - моно-и диэтаноламидов (С10—С16 и С10—С13 соответственно); текстильно-вспомогательных веществ (С14—С16, С14—С18); свечном производстве (С14—С20); алифатических аминов и амидов; мягчителей и диспергаторов ингредиентов для РТИ; добавок к ракетному топливу, увеличивающих противоизносные свойства (С17—С20); искусственной кожи; депрессорных присадок к дизельным топливам (С21—С25).
Важнейшие индивидуальные натуральные кислоты - линолевая, линоленовая и арахидоновая, принимающие участие в синтезе простагландинов в организме человека (см. Незаменимые жирные кислоты), рицинолевая кислота, олеиновая кислота, стеариновая кислота
Мощности по производству высших жирных кислот в капиталистических странах оцениваются в 6,5 млн. т/год (1999). Загрузка мощностей 50-80%. При этом на долю синтетических кислот приходится только 10%. Ресурсы производства натуральных высших жирных кислот значительны (см. Жиры животные, Растительные масла), однако фракционный состав их узок и ограничивается кислотами С12—С18, а главным образом C16 и С18. Возросший интерес к кислотам до С12и выше С20 стимулирует развитие производства высших жирных кислот из нефтехимического сырья.
Высшие жирные кислоты С6—С20 - умеренно токсичные вещества; оказывают раздражающее действие на неповрежденную кожу и слизистые оболочки; ПДК паров суммы кислот 5 мг/м3 (в пересчете на уксусную кислоту).