Классификгетерофсоедин:
ОН-гидроксильная гр, -NH2аминогруппа, -С=С- двойн связь, СОН- альдегиднгр, С=О кетоногруппа, СООН-карбоксильнгр, -SO3Hсульфогруппа, –SHтиольная
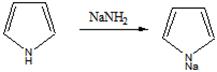
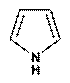 Пиррол- пятичленныйгетероциклимеет плоский замкнут цикл. Наличие pП сопряженияПиррольный азот в sp2 гибр. Пиррол вход в сост гемоглобина, хлорофилла.этобесцвжидк почти не раствор в воде, быстро темнеющ на воздухе.Ароматичность пиррола как и бензола обусловлналичП-системы:по одному электрону от четырёх sp2-гибридизированных атомов углерода и еще 2 n-электрона sp2-гибридизированного пиррольного атома азота.этанеподелённая пара електроновявл частью ароматического секстета и поэтому пиррол лишён основных св-в. А при взаим с Na, K группа-NHпроявлкислотнх-р. Полученные соли пирролнатрий или пирролкалийразлагаются водой образуя исходный пиррол и гидроксид ме.
Пиррол- пятичленныйгетероциклимеет плоский замкнут цикл. Наличие pП сопряженияПиррольный азот в sp2 гибр. Пиррол вход в сост гемоглобина, хлорофилла.этобесцвжидк почти не раствор в воде, быстро темнеющ на воздухе.Ароматичность пиррола как и бензола обусловлналичП-системы:по одному электрону от четырёх sp2-гибридизированных атомов углерода и еще 2 n-электрона sp2-гибридизированного пиррольного атома азота.этанеподелённая пара електроновявл частью ароматического секстета и поэтому пиррол лишён основных св-в. А при взаим с Na, K группа-NHпроявлкислотнх-р. Полученные соли пирролнатрий или пирролкалийразлагаются водой образуя исходный пиррол и гидроксид ме.
 / пиррол выдерживает кислоты.при их взаим получают смолу. Выдержка пиррола кислот учитывается при выборе реагентов реакции электрофильн замещения. Восстановл пиррола протек ступенчато
/ пиррол выдерживает кислоты.при их взаим получают смолу. Выдержка пиррола кислот учитывается при выборе реагентов реакции электрофильн замещения. Восстановл пиррола протек ступенчато  (2Н)→
(2Н)→  3-пирролин (2Н)→
3-пирролин (2Н)→ 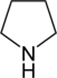 Пирролидин -этот конечн продукт обладсильноосновнсв-вами.
Пирролидин -этот конечн продукт обладсильноосновнсв-вами.
 +Cl2=
+Cl2=  Cl+HCl а-хлорпиррол
Cl+HCl а-хлорпиррол
Сульфир-е пиррола происх в прис С5Н5NSO3=пиридинсульфотриоксид
В присут СН3Cl= а-метилпиррол
Оксисляется до амидомалеиновой к-ты
1 6. Производные пиррола – гемоглобин, цитохромы, хлорофилл, каталаза
Производные Пиррол обыкновенно разделяют на два класса: п -производные, получающиеся замещением водорода NH-группы, и с -производные — замещением водорода СН-групп
Гемоглобин осн. белок дыхат. цикла, участвующий в переносе О2от органов дыхания к тканям, а в обратном направлении - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям
Гемоглобин явл сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами A-H (От N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этапростетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93 положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи (участок E). Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
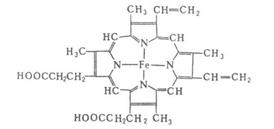
ЦИТОХРОМЫ, сложные белки (гемопротеиды), содержащие в качестве простетич. группы гем. Служат переносчиками электронов в процессах внутриклеточного дыхания, окислит. фосфорилирования,фотосинтеза, ферментативного гидроксилирования и в др. биол. окислит.-восстановит. р-циях. Цитохромы найдены у всех животных, растений и микроорганизмов. Известно неск. десятков индивидуальных цитохромов, многие из к-рых выделены в гомогенном состоянии. Определены первичные структуры и пространственная организация многих цитохромов наиб.хорошо изучены св-ва цитохрома с. В зависимости от природы гемацитохромы делят на 4 группы, обозначаемые буквами а, b, с и d. У цитохрома а гем имеет строение протопорфирина (см. Порфирины) и содержит формильный заместитель; цитохром b содержит протогем (ферропротопорфирин), нековалентно связанный с полипептидной цепью; у цитохрома с боковые заместители протопорфиринаковалентно связаны с полипептидной цепью; у цитохрома d гем представлен дигидропорфирином (хлорином). Атом Fe, входящий в состав гемов цитохромов и подвергающийся окислениюи восстановлению, координирован 4 связями с атомами N порфириновых колец и 2 - с лигандами, принадлежащими полипептидным цепям (остатки гистидина, цистеина). Нек-рыецитохромы содержат неск. одинаковых или разных гемов.
Все цитохромы ярко окрашены и имеют характерные спектры поглощения света в видимой области, меняющиеся при их окислении или восстановлении. В типичном спектре имеются три основные полосы поглощения  полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленностицитохрома.
полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленностицитохрома.
Донорами электронов для цитохромов обычно служат флавины, гидрохиноны, железо-серные белки или другие цитохромы; акцепторами - другие цитохромы или кислород (цитохромоксидазы). Нек-рыецитохромы (цитохромоксидаза, цитохром Р-450) прочно связаны с мембранами митохондрий, микросом (липопротеидные комплексы) и не раств. в воде, другие (напр., цитохром с) раств. в ней.
Цитохромы реагируют с лигандами, конкурирующими с естественным координац. окружением атома Fe гемовСвязывание этих лигандов приводит к изменению спектральных св-в и инактивациицитохромов.
ХЛОРОФИЛЛЫ прир. макрогетероциклич. пигменты, участв в процессе фотосинтеза; относятся к металлопорфиринам Зеленая окраска растобусловл присутствием хлорофиллов, локализованных во внутриклеточн органеллах (хлоропластах или хроматофорах) в виде пептидных комплексов.хлорофиллы предст собой производные порфина, молекулы к-рых содержат циклопентаноновое кольцо, конденсированное с порфириновым макроциклом, центральный атом Mg и разл. заместители; одно или два пиррольных цикла молекулах частично гидрированы, см., напр., ф-лу I. В пиррольном кольце Dмолекул хлорофиллов к остатку пропионовой к-ты обычно присоединены остатки высокомол. изопреноидных спиртов, к-рые придают хлорофиллам способность встраиваться в липидные слои мембран хлоропластов. Для хлорофиллов, как и для порфиринов, используется номенклатура ИЮПАК или Фишера.
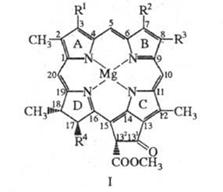 Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумякарбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имееткарбоксиметиловую группу при С10, фитоловый эфир пропионовой кислоты — при С7. Удалениемагния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин.Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида(хлорофиллид, лишенный атома металла, известен как феофорбид a).
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумякарбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имееткарбоксиметиловую группу при С10, фитоловый эфир пропионовой кислоты — при С7. Удалениемагния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин.Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида(хлорофиллид, лишенный атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены
Каталаза (Н2О2:Н2О2— оксидоредуктаза) фермент, катализирующий реакцию разложения перекиси водорода на воду и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2Н2О. Биологическая роль К. заключается в деградации перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз, и обеспечении эффективной защиты клеточных структур от разрушения под действием перекиси водорода.недостаточность К. явл 1 из причин акаталазии — наследств забол, проявляющегося изъязвлением слизист оболочки носа и ротовой пол, иногда выраж выпадением зубов. К. широко распространена в тканях животных, в т.ч. человека, растений и в микроорганизмах К. представляет собой гемопротеин, простетической группой которого является гем, содержащий ион трехвалентного железа. Молекула К. состоит из четырех, по-видимому, идентичных субъединиц с молекулярной массой 60 000 и имеет соответственно четыре простетические группы. Феррипротопорфириновые группы гема прочно связаны с белковой частью фермента — апофермектом и не отделяются от него при диализе. Оптимальная величина рН для К. находится в интервале значений 6,0—8,0.