Решение задач на теплообмен
С использованием уравнения теплового баланса
(методические рекомендации)
Киров
ББК 74.204.2
С 17
Печатается по решению редакционно-издательского совета Лицея естественных наук г. Кирова
Рецензент: К.А. Коханов, кандидат педагогических наук, старший преподаватель кафедры дидактики физики Вятского государственного гуманитарного университета, заместитель заведующего кафедрой дидактики физики.
С 17 Самарин Г.Г. Решение задач на теплообмен с использованием уравнения теплового баланса: Методические рекомендации. – Киров: Издательство Лицея естественных наук, 2002. – 35 с.
Пособие рекомендовано учащимся, желающим получить практические навыки в решении задач на теплообмен, и может быть полезным для учителей и абитуриентов.
© Лицей естественных наук, 2002
© Г.Г. Самарин, 2002
При соприкосновении тел, имеющих разные температуры, между этими телами происходит теплообмен. С точки зрения молекулярно-кинетической теории, это объясняется так: молекулы более нагретого тела имеют большую кинетическую энергию, чем молекулы тела, менее нагретого. При «столкновениях» молекул соприкасающихся тел происходит процесс выравнивания их средних кинетических энергий. Молекулы более нагретого тела теряют часть своей кинетической энергии, при этом нагретое тело будет остывать. Кинетическая энергия молекул холодного тела возрастает, поэтому температура этого тела будет увеличиваться. В конечном итоге кинетические энергии молекул обоих тел сравняются, и температуры тел станут одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в процессе теплообмена, называют количеством теплоты (Q).
Количество теплоты, как и все другие виды энергии, измеряется в системе СИ в Джоулях: [Q] = Дж. *
Нагревание или охлаждение
При нагревании или охлаждении тела количество теплоты, поглощаемое или выделяемое им, рассчитывается по формуле:
Q = сm(t2 – t1),(1)
где m – масса тела, кг;
(t2 – t1) – разность температур тела,°С (или К);
с – удельная теплоёмкость вещества, из которого состоит тело,
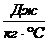 или
или 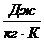 .
.
Удельная теплоёмкость вещества – это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1°С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1°С).
Например, Своды = 4200 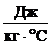 , Сльда, водяного пара = 2100
, Сльда, водяного пара = 2100 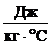 , Ссвинца = 140
, Ссвинца = 140 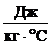 , Смеди = 380
, Смеди = 380 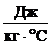 , Сжелеза, стали = 460
, Сжелеза, стали = 460 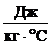 , Салюминия = 920
, Салюминия = 920 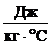 .
.
Значения удельных теплоемкостей других веществ можно найти в справочниках, а также в школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия увеличивается. Это требует притока энергии к телу от других тел. Значит, оно поглощает некоторое количество теплоты, принимая его от других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия уменьшается. Поэтому остывающее тело отдаёт кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в результате теплообмена, обозначают греческой буквой q (тэта).
В формуле (1) произведение cm для каждого конкретного тела есть величина постоянная. Её называют теплоёмкостью тела и обозначают С:
C = c×m. (2)
Размерность теплоемкости: [С] = 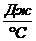 . Теплоемкость тела показывает, сколько энергии нужно подвести к данному телу, чтобы нагреть его на 1°С (или сколько энергии выделяет это тело, остывая на 1°С).
. Теплоемкость тела показывает, сколько энергии нужно подвести к данному телу, чтобы нагреть его на 1°С (или сколько энергии выделяет это тело, остывая на 1°С).
Теплообмен между телами, имеющими одинаковые температуры, не происходит, даже если контактируют вещества, находящиеся в разных агрегатных состояниях. Например, при температуре плавления (0°С) лёд и вода могут находиться бесконечно долго, при этом количество льда и количество воды останутся неизменными. Аналогично ведут себя пар и жидкость, находящиеся при температуре кипения. Теплообмен между ними не происходит.