ХИМИЯ
Методические рекомендации к практическим занятиям
Для студентов всех специальностей
Дневной и заочной форм обучения
КОНЦЕНТРАЦИИ РАСТВОРОВ.
СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ.
ВТОРОЙ ЗАКОН РАУЛЯ

Могилев 2019
ББК 24.1
Х 46
Рекомендовано к опубликованию
Центром менеджмента качества образовательной деятельности
ГУ ВПО «Белорусско-Российский университет»
Одобрено кафедрой «Технологии металлов» «23» апреля 2019 г., протокол № 10
Составитель канд. биол. наук, доц. И. А. Лисовая
Рецензент канд. техн. наук, доц. М. Н. Мироноа
В методических указаниях представлены основные понятия темы, способы выражения концентрации растворов, закон Рауля. Приведены примеры решения некоторых задач, контрольные вопросы и упражнения.
Учебное издание
ХИМИЯ
Ответственный за выпуск Д. И. Якубович
Технический редактор А. А. Подошевко
Компьютерная верстка Н. П. Полевничая
Подписано в печать. Формат 60×84/16. Бумага офсетная. Гарнитура Таймс. Печать трафаретная. Усл. печ. л.. Уч.-изд. л.. Тираж 71 экз. Заказ №
Издатель и полиграфическое исполнение:
Государственное учреждение высшего профессионального образования
«Белорусско-Российский университет».
Свидетельство о государственной регистрации издателя,
изготовителя, распространителя печатных изданий
№ 1/156 от 24.01.2014.
Пр. Мира, 43, 212000, Могилев.
© «Белорусско-Российский
университет», 2019
Растворы
Раствором называется термодинамически устойчивая однофазная (гомогенная) система переменного состава, состоящая из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Раствор состоит из растворителя и растворенного вещества.Обычно растворителем считают компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор (например, в водном растворе соли растворителем является вода). В случае одинакового агрегатного состояния компонентов (например, вода и спирт) растворителем считают тот компонент, который преобладает в растворе.
Жидкие растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе технически и жизненно важные, лежащие в основе обмена веществ в живых организмах. Так как на равновесие и кинетику этих реакций оказывает влияние растворитель, то процессы в жидких растворах имеют свои особенности – наличие сил взаимодействия между молекулами растворителя и частицами растворенного вещества, а также возможность перемещения частиц относительно друг друга. Материалы, излагаемые далее в методических указаниях, относятся к жидким растворам.
Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными, например: раствор нафталина в бензоле, раствор гидроксида калия в спирте и др.
Способы выражения состава растворов
Концентрацией раствора называется отношение количества или массы вещества, содержащегося в растворе, к определенной массе или определенному объему раствора или растворителя.
Введем обозначения:
mВ-ВА – масса растворенного вещества, г(в СИ – кг). Здесь и далее указаны размерности величин, которые наиболее часто встречаются при химических расчетах. Жирным шрифтом выделены наиболее часто используемые размерности;
mР-РА – масса раствора, г, кг;
mР-ЛЯ – масса растворителя, г, кг;
VР-РА – объем раствора, мл, л (или соответственно: см3, дм3);
VР-ЛЯ – объем растворителя, мл, л (соответственно: см3, дм3);
ρР-РА – плотность раствора, г/мл, кг/л (соответственно: г/см3, кг/дм3);
ρР-ЛЯ – плотность растворителя, г/мл, кг/л (соответственно: г/см3, кг/дм3);
MВ-ВА – молярная масса растворенного вещества, г/моль;
MР-ЛЯ – молярная масса растворителя, г/моль;
MЭК – молярная масса эквивалентов растворенного вещества, г/моль;
nВ-ВА – количество растворенного вещества, моль;
nЭК – количество эквивалентов вещества, моль;
nР-ЛЯ – количество растворителя, моль.
Взаимный пересчет параметров раствора, растворителя и растворенного вещества проводят с учетом следующих соотношений (для двухкомпонентного раствора: одно вещество и растворитель, если веществ несколько, то необходимо учитывать массы всех веществ):
mР-РА = mВ-ВА + mР-ЛЯ ;
mР-РА = ρР-РА · VР-РА ;
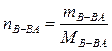 ;
;  ;
;  ;
;
VР-РА(2) ≠ VР-РА(1) + VР-ЛЯ; VР-РА(3) ≠ VР-РА(1) + VР-РА(2).
Приведем наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе. В нижеприведенных формулах объемы взяты в литрах, массы – в граммах. При использовании указанных формул для решения задач, в условиях которых объемы и массы взяты в других единицах измерения, их предварительно пересчитывают.
Массовая доля ω – безразмерная величина, равная отношению массы компонента в растворе к массе всего раствора (размерности масс одинаковы):

Процентная концентрация С% – показывает, сколько граммов растворенного вещества содержится в 100 г раствора:


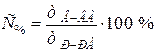 .
.
Молярная концентрация СМ – отношение количества вещества, содержащегося в растворе, к объему раствора, моль/л (сокращенное обозначение молярной концентрации в задачах – М, например: 2М – двумолярный раствор, т. е. СМ = 2 моль/л):
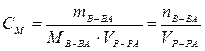 .
.
Молярная концентрация эквивалентов (эквивалентная СЭК , или нормальная концентрация СН) – это отношение количества эквивалентов вещества, содержащегося в растворе, к объему этого раствора, моль/л (сокращенное обозначение – н):
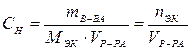 .
.
Молярные массы эквивалентов веществ рассчитываются по формуле
MЭК = fЭК · MВ-ВА,
где fЭК – фактор эквивалентности:
– для кислоты
 ,
,
где nH – основность кислоты;
– для основания
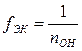 ,
,
где nOH – кислотность основания;
– для соли
 ,
,
где n – число атомов металла в формульной единице соли;
B – валентность металла.
Для растворов с нормальной концентрацией справедлива формула, которая вытекает из закона эквивалентов:
nЭК (1) = nЭК (2),
следовательно,
CН (1) · VР-РА (1) = CН (2) · VР-РА (2).
Моляльность Сm, моль/кг – определяется количеством вещества в
1 кг (1000 г) растворителя:
 .
.
Молярная (мольная) доля растворенного вещества N – отношение количества растворенного вещества к общему количеству всех вещества, составляющих раствор, включая растворитель:
 .
.
Молярная доля может быть выражена в долях единицы, в процентах. Сумма мольных долей всех компонентов раствора равна единице.
В случае двухкомпонентного раствора
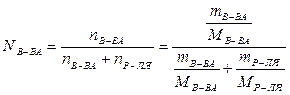 .
.
Титр раствора СТ или Т, г/мл или г/см3 – масса вещества, содержащаяся в 1 мл раствора:
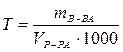 .
.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Примеры решения задач
Пример 1 – На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение
Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т. е.


или
CН (1)· VР – РА (1) = CН (2)· VР – РА (2).;
50 · C 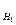 = 25 · 0,5
= 25 · 0,5  C
C 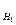 =
=  н.
н.
Пример 2 – Определите моляльность 8-процентного раствора гидроксида натрия.
Решение
Моляльность выражается числом молей растворенного вещества в 1000 г растворителя:
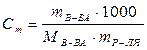 .
.
Поскольку соотношение между веществом и растворителем для заданного раствора не зависит от его массы, то необходимые для решения данные вводим в условие задачи. Пусть масса раствора равна 100 г. Тогда из определения процентной концентрации следует, что в 100 г 8-процентного раствора содержится 8 г вещества и 100 – 8 = 92 г растворителя. Молярная масса NaOH равна 40 г/моль. Тогда
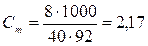 моль/кг.
моль/кг.
Пример 3 – К 1 л 10-процентного раствора КОН (плотность
1,092 г/см3) прибавили 0,5 л 5-процентного раствора КОН (плотность
1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение
Масса 1 л 10-процентного раствора КОН
mР-РА = ρР-РА ·VР-РА · 1000 = 1,092 · 1 · 1000 = 1092 г.
В этом растворе содержится
 109,2 г КОН.
109,2 г КОН.
Масса 0,5 л 5-процентного раствора КОН
mР-РА = ρР-РА ·VР-РА · 1000 = 1,045 · 0,5 · 1000 = 522,5 г.
В этом растворе содержится
 26,125 г КОН.
26,125 г КОН.
В полученном растворе (2 л) содержится 109,2 + 26,125 = 135,325 г КОН.
Отсюда молярность этого раствора
 =
=  м.
м.
Пример 4 – Какой объем 96-процентной серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н раствора?
Решение
Молярная масса эквивалента
Мэк (H 2 SO 4) =  г/моль.
г/моль.
Для приготовления 3 л 0,4 н раствора требуется
 0,4 ∙ 49 ∙ 3 = 58,8 г H2SO4.
0,4 ∙ 49 ∙ 3 = 58,8 г H2SO4.
Масса 1 см3 96-процентной Н2SО4 равна 1,84 г. В этом растворе содержится
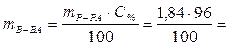 1,766 г Н2SO4.
1,766 г Н2SO4.
Следовательно, для приготовления 3 л 0,4 н раствора надо взять 58,8: 1,766 = 33,3 см3 раствора этой кислоты.