Определите массовую долю сахарозы С12Н22011 в воде, если известно, что температура замерзания этого раствора составляет минус 0,21 °С.
Решение
Из данных задачи следует, что 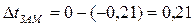 град. Для определения массовой доли сахарозы в растворе воспользуемся уравнением
град. Для определения массовой доли сахарозы в растворе воспользуемся уравнением
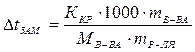 ,
,
в которое подставим известные величины: ККР – криоскопическую константу, ККР = 1,86 град · моль–1 · кг, 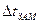 и молярную массу сахарозы М(С12Н22011) = 342 г/моль. Отношение
и молярную массу сахарозы М(С12Н22011) = 342 г/моль. Отношение
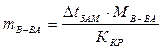
представляет собой массу растворенного вещества, приходящуюся на 1000 г растворителя. Тогда
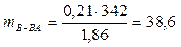 г.
г.
На 1000 г растворителя приходится 38,6 г сахарозы, поэтому для определения массовой доли растворенного вещества можно воспользоваться формулой
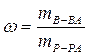
или составить пропорцию:
1038,6 г раствора содержит 38,6 г сахарозы;
100 г раствора – хг сахарозы.
Следовательно, массовая доля растворенного вещества составляет 3,71 %.
Контрольные вопросы и задачи
1 Какое давление называется давлением насыщенного пара?
2 Запишите математические выражения второго закона Рауля и объясните физический смысл величин, входящих в это выражение.
3 Одинаковые навески мочевины CO(NH2)2 и сахарозы C12H22O11 растворили в одинаковом количестве воды в одинаковых условиях. Для какого из растворов значение  будет больше?
будет больше?
4 Одинаково ли понижение температуры замерзания 0,1 М водных растворов глюкозы С6Н12О6 и мочевины CO(NH2)2?
Задача 1. На сколько градусов повысится температура кипения водного раствора мочевины CO(NH2)2, если в 300 г воды растворить 8,5 г вещества?
Задача 2. Вычислите массовую долю метанола СН3ОН в водном растворе, температура замерзания которого равна минус 2,79 °С.
Задача 3. Определите температуру кипения раствора 1 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира равна 35,6 °С,
КЭ = 2,16 °С.
Задача 4. Раствор 1,05 г неэлектролита в 30 г воды замерзает при
минус 0,7°С. Вычислите молекулярную массу неэлектролита.
Задача 5. Вычислите количество этиленгликоля С2Н4(ОН)2, которое необходимо прибавить на каждый килограмм воды для приготовления антифриза с точкой замерзания минус 15 °С.
Задача 6. Для приготовления антифриза на 30 л воды взято 9 л глицерина С3Н5(ОН)3. Чему равна температура замерзания приготовленного антифриза? Плотность глицерина равна 1261 кг/м3.
Задача 7. Определите температуру кипения 10-процентного водного раствора глюкозы С6Н12О6.
Задача 8. Раствор, содержащий 0,162 г серы в 20 г бензола (С6Н6), кипит при температуре на 0,081° выше, чем чистый бензол. Рассчитайте молекулярную массу серы в растворе. Сколько атомов содержится в одной молекуле серы?
Список литературы
1 Глинка, Н. Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка; под ред. В. А. Попкова. – М.: Юрайт, 2010. – 886 с.
2 Глинка, Н. Л. Задачи и упражнения по общей химии: учеб. пособие для вузов / Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной. – М.: Интеграл-Пресс, 2011. – 240 с.
3 Коровин, Н. В. Общая химия: учебник для технических направлений и специальностей вузов / Н. В. Коровин. – М.: Высш. шк., 2009. –
558 с.
4 Жарский, И. М. Теоретические основы химии: сборник задач /
И. М. Жарский, А. Л. Кузьменко, С. Е. Орехова. – Минск: Аверсэв, 2008. – 397 с.: ил.