б
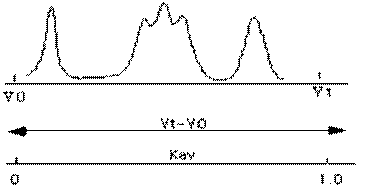
Рис. 7. а - Наглядная демонстрация параметров (заштрихованная зона) хроматографической колонки при определении величины Кav (по [https://kirschner.med.harvard.edu/files/protocols/GE_gelfiltration.pdf] с изменениями); б - профиль элюции соединений с различной молекулярной массой, полученный в результате гель-хроматографии, и соответствующие им величины Кav (по [https://xray.bmc.uu.se] с изменениями).
Величина Kav пропорциональна Kd, но зависит от конкретных условий эксперимента.
Формула (10) служит определением Kav и ниоткуда не следует. Поскольку (Vt-Vo)³Vi, величина Kav всегда должна быть меньше или равна 1. Если на практике полученная величина Kav>1 (т.е. Ve>Vt), это скорей всего свидетельствует о сорбции молекул вещества на носителе. Иногда сорбция обусловлена ионными взаимодействиями, и тогда ее можно избежать, варьируя значение рН буферного раствора и/или увеличивая ионную силу. Если сорбция обусловлена гидрофобными взаимодействиями, ионная сила должна быть минимальной.
Степень разделения веществ и соответствующих им пиков на хроматограмме называется разрешением, которое может быть плохим и хорошим (рис. 8). На разрешение пиков при гель-хроматографии влияют многие факторы: объем наносимого образца, соотношение объемов образца и колонки, размеры колонки, размеры частиц геля и их пор, плотность упаковки геля в колонке, скорость тока элюента, вязкость образца и элюента, и др. Наиболее значимыми из них являются объем исследуемого образца и размеры гель-фильтрационной колонки.
Плохое разрешение Хорошее разрешение
Конц-ция Конц-ция
Объем элюции Объем элюции
а б
Рис. 8. Схематическое изображение плохого (а) и хорошего (б) разрешений пиков разделяемых веществ при хроматографии. (по [https://sbio.uct.ac.za/Sbio/postgrad/modules/GRD/chromatography/gf3.php] с изменениями.
2.2. Применение гель-хроматографии. Гель-хроматографию можно использовать для решения двух основных задач:
1) для отделения группы мелких молекул от группы молекул с высокой молекулярной массой;
2) для фракционирования биополимеров с различной молекулярной массой (фракционирование с высоким разрешением) и для определения молекулярной массы макромолекул.
2.2.1. Разделение групп веществ. Частогель-хроматографиюиспользуют для быстрого удаления из растворов макромолекул низкомолекулярных соединений. В качестве примеров такого типа разделения можно привести обессоливание белков и смену буфера, освобождение от радиоактивных предшественников и детергентов, очистку небольших белков от ДНК и других высокомолекулярных соединений и т.п.
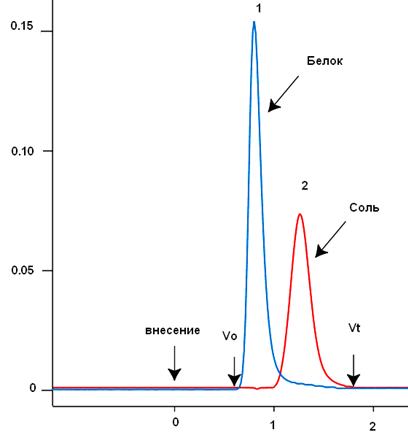
Для «группового разделения», как правило, используют относительно жесткие, мелкопористые матрицы с крупными гранулами, позволяющими существенно увеличить скорость тока раствора через носитель (например, сефадексы G-10, G-25 или биогель Р-6) (см. ниже). При таком разделении объем образца, наносимого на колонку, может достигать 20-30% от общего объема колонки (Vt). В свою очередь, сама колонка может быть относительно широкой и короткой: отношение высоты колонки (h) к ее диаметру (d) - 10:1 и даже ниже. На рис. 9 представлен типичный профиль элюции при обессоливании белка. Большие молекулы белка элюируются в свободном объеме (или сразу после свободного объема) колонки (V0). Для хорошо упакованной колонки свободный объем равен ~30% от общего объема колонки. Маленькие молекулы соли двигаются по колонке медленнее, задерживаясь в гранулах геля, но не разделяются друг от друга. Объем их элюции составляет ~2/3 от общего объема колонки (рис. 9) и определяется по электропроводности элюирующего раствора.
А280 Электропроводность, mS
 мин
мин
Рис. 9. Обессоливание белка методом гель-фильтрации. 1 – элюция белка (оптическое поглощение при 280 нм), 2 – электропроводность (mS) по [https://kirschner.med.harvard.edu/files/protocols/GE_gelfiltration.pdf] с изменениями.
2 .2.2. Фракционирование «с высоким разрешением». Этот метод используют для получения индивидуальных компонентов смеси, для отделения мономеров от агрегатов (что трудно бывает достичь с помощью других видов хроматографии), а также для определения молекулярной массы молекул. Чаще всего этот подход используют для разделения смеси белков и определения их молекулярной массы.
Ввиду относительно низкой (по сравнению с другими хроматографическими методами) эффективности, этот способ разделения используют, когда число компонентов смеси невелико, как правило, на последних стадиях выделения и очистки. При этом колонка должна быть узкой и длинной (отношение h:d - 20:1-100:1), а объем наносимого на колонку образца зависит от состава разделяемой смеси и должен лежать в диапазоне 0,5-4% от общего объема колонки (как правило, ≤2%).
Для того чтобы уменьшить объем образца до нужного объема, его бывает полезно сконцентрировать. Однако концентрация в нем не должна превышать 70 мг/мл, поскольку на эффективность разделения будет негативно влиять вязкость раствора разделяемой смеси.
На качество разделения в процессе хроматографии будет также влиять скорость элюции. Если при обессоливании белковых фракций скорость элюции может быть довольно большой (~20 мл/cм2×ч) (если, конечно, гель не будет при такой скорости сжиматься), то при фракционировании белков скорость элюции желательно значительно снизить. Она не должна быть слишком высокой, так как в этом случае не будет хватать времени для достижения полного равновесия между подвижной и неподвижной фазами, что приведет к недостаточно эффективному разделению белковых зон. В то же время слишком медленная скорость элюции не только удлинит процесс хроматографии, но и вызовет уширение белковых пиков за счет продольной диффузии и, как следствие, также приведет к плохому разделению белков. Оптимальную скорость элюции можно найти в соответствующих справочниках или подобрать экспериментально.
Для разделения смеси белковых молекул, не сильно различающихся по размеру, и определения их молекулярной массы важно, чтобы величины их молекулярных масс лежали в области эффективного фракционирования. Диапазон размера молекул, которые могут быть разделены на данном сорбенте, называется селективностью сорбента, а зависимость величины Кav разделяемых веществ от логарифма их молекулярной массы – кривой селективности (рис. 10). Обычно эта кривая линейна в диапазоне Кav от 0,1 до 0,7 (рис. 10). Селективность гелей, также как и предел исключения (предел эксклюзии) – предельная молекулярная масса частицы, еще проникающей в поры геля, как правило, указывается в справочниках и инструкциях, прилагаемых к хроматографическим носителям фирмами-поставщиками.
Если особый интерес при разделении молекул представляет конкретный компонент смеси, лучше выбрать такой сорбент, для которого логарифм его молекулярной массы попадает в середину кривой селективности.
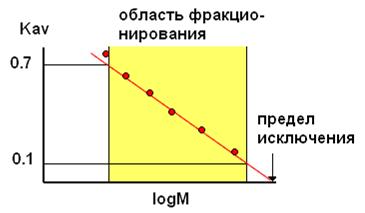
Рис. 10. Схематическое отображение селективности сорбента при фракционировании белков методом гель-хроматографии (кривая селективности)
(по [https://sbio.uct.ac.za/Sbio/postgrad/modules/GRD/chromatography/gf3.pgp] с изменениями.
2.2.2.1. Определение молекулярной массы белков с помощью метода гель-фильтрации. Часто гель-хроматографию применяют для определения молекулярной массы биополимеров, особенно белков. Для этого через гель-фильтрационную колонку пропускают набор белков с известной молекулярной массой и определяют величины их Кav. Строят калибровочный график зависимости Кav этих белков от десятичного логарифма их молекулярных масс (этот график, как правило, линеен для глобулярных белков) (рис. 11). Определив экспериментально величину Кav для исследуемого белка, по такому калибровочному графику можно рассчитать его молекулярную массу. Однако такой подход довольно приблизителен и годится лишь для глобулярных белков одинаковой плотности.
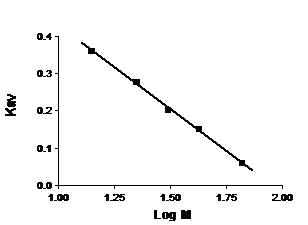
Рис. 11. Зависимость Кav от десятичного логарифма молекулярной массы белка (кДа). (Калибровочный график для определения молекулярной массы белка).
2.3. Сорбенты для гель-хроматографии. Как уже упоминалось выше, для создания пористых гранул используют полимерные гели. Различныекоммерческие носители позволяют разделить биомолекулы с молекулярными массами от 0,1 до 8000 кДа.Среди сорбентов наиболее широкое применение нашли сефадексы, супердексы, молселекты, сефакрилы, сефарозы, суперозы, биогели, ультрогели, toyopearl HW.
Сефадекс [1] - полисахарид декстран, обработанный эпихлоргидрином,
СН2—СН2—СН2Сl
\ /
О
за счет чего образуются многочисленные поперечные сшивки (рис. 12), приводящие к формированию крупных гидрофильных зерен, нерастворимых в воде. Сефадексы - относительно мягкие гели, легко сжимаются, а в водных растворах сильно набухают. Изменяя долю сшивки, можно варьировать средний размер пор, образуемых пространственной сеткой сшитого геля, и, соответственно, жесткость геля (чем меньше сшивок, тем мягче гель) и интервал фракционирования. Сефадексы устойчивы при рН 2-12 в присутствии мочевины и детергентов, в органических растворителях, но разрушаются в сильных кислотах и в результате длительного воздействия окислителей.
Существует много сорбентов на основе декстрана - от самых мелкопористых (сефадекс G-10) до наиболее крупнопористых (сефадекс G-200) (табл. 2). Чем крупнее поры, тем больше молекул воды связывается с гелем при его набухании. Номер в маркировке сефадекса характеризует
его пористость и означает количество воды (в мл), которое связывается с 10 г сухого геля. Помимо величины пор, сефадексы отличаются по размерам самих сферических гранул.
Молселект - матрица для гель-фильтрации с аналогичными сефадексу свойствами, выпускавшаяся венгерской фирмой «Reanal».
Супердекс – сорбент, представляющие собой поперечно сшитые нити агарозы и декстрана. По своим свойствам похож на сефадекс, однако обладает большей прочностью (выдерживает более высокое давление). Сефакрил сочетает в себе свойства сефадекса и полиакриламидного геля (ПААГ), т.к. нити декстрана в нем сшиты метиленбисакриламидом, что позволяет получить жесткие гели, пористость которых легко контролировать (рис. 13). Сефакрил гидрофилен, химически инертен, термостабилен и может использоваться при более высоких скоростях элюции, чем сефадекс с той же пористостью. Сефакрилы применяются главным образом для фракционирования и очистки крупных молекул (плазмид, рибосом, вирусов, фрагментов ДНК, белков с большой молекулярной массой) и не могут заменить сефадексы малых номеров.
Сефароза - матрица, выпускаемая в виде суспензии на основе гелей агарозы (рис. 14). Гели сефарозы достаточно жесткие, но уступают по этому свойству сефакрилам. Гранулы сефарозы легко крошатся при неосторожном
Таблица 2. Сефадексы, применяемые для гель-хроматографии.
| Сефадексы | Диапазон фрак-ния белков | Предел эксклюзии (декстраны) | Применение и фракционируемые соединения |
| G-10 | <700 Да | <700 Да | Обессоливание, смена буфера; разделение очень низкомолекулярных соединений, пептидов |
| G-15 | <1,5 кДа | <1,5 кДа | Обессоливание, смена буфера; разделение низкомолекулярных соединений, пептидов |
| G-25 | 1-5 кДа | 0,1-5 кДа | Обессоливание, смена буфера; разделение маленьких пептидов и белков; отделение меченных белков и ДНК от свободной метки |
| G-50 | 1,5-30 кДа | 0,05-10 кДа | Обессоливание, смена буфера |
| G-75 | 3-80 кДа | 1-50 кДа | Разделение белков |
| G-100 | 4-150 кДа | 1-100 кДа | Разделение белков, оптимален для определения молекулярной массы |
| G-150 | 5-300 кДа | 1-150 кДа | Разделение белков |
| G-200 | 5-600 кДа | 1-200 кДа | Разделение белков |
* Сефадексы могут различаться размерами самих сферических гранул и делятся на следующие классы:
С (coarse): 100-300 мкм (используются для очень грубых образцов)
М (medium): 50-150 мкм (используются для стандартной лабораторной работы)
F (fine): 20-80 мкм (используются для препаративной лабораторной работы)
SF (superfine): 10-40 мкм (используются для высококачественного разделения, но характеризуются низкой скоростью тока).
перемешивании, не выдерживают температуры выше 400С и замораживания-оттаивания, не отличаются химической стойкостью, но устойчивы в водных растворах при рН 4-9. «Сшивки» нитей агарозы 2,3-дибромпропанолом (рис. 14б) придают сефарозе химическую, термическую и механическую устойчивость и большую жесткость, что позволяет увеличить скорость элюции. Однако они никак не сказываются на области фракционирования молекул, которая для «сшитой» и обычной агарозы практически совпадает. В фирменном обозначении на наличие сшивок указывают буквы «CL» («cross-linked»).
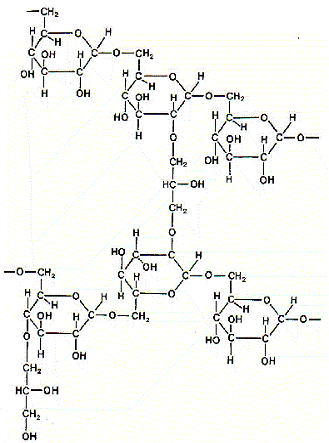
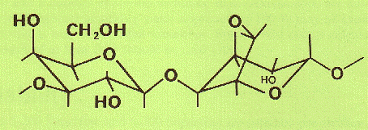
Рис. 12. Структурная формула сефадекса (по [Рharmacia Fine Chemicals]).
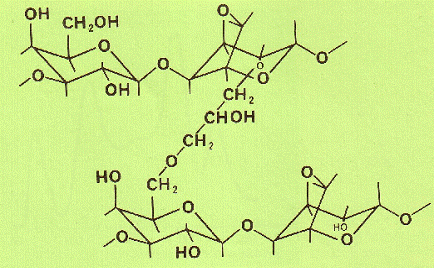
Рис. 13. Структурная формула сефакрила (по [Pharmacia Fine Chemicals]).
а
б
Рис. 14. Структура «простой» (а) и «сшитой» CL (б) агарозы (по [Pharmacia Fine Chemicals]).
Многократно сшитые нити агарозы получили в последнее время новое название – суперозы. Они выдерживают на порядок большее давление, чем агароза и стабильны при рН 2-14.
Свойства биогелей серии А - носителей, выпускаемых также на основе гелей агарозы фирмой «Bio-Rad» (США) - аналогичны свойствам сефарозы. Марки гелей различаются диаметром гранул и процентом агарозы, который определяет область фракционирования белков. Macro-Prep SE гели, в основе которых сферические (с диаметром ~40 мкм) поперечно-сшитые гранулы высокоочищенной агарозы обладают большей механической и химической стабильностью, а также разрешающей способностью.
Помимо гелей на основе агарозы фирма «Bio-Rad» выпускает сферические матрицы на основе полиакриламидных гелей (ПААГ) (рис. 14) - биогели серии Р, в которых пористость геля определяется концентрацией акриламида. В зависимости от марки геля могут также варьировать размеры гранул. Свойства этих гелей во многом сходны со свойствами сефадексов.
|
CO
|
UCH2UCHU [CH2UCHU]nUCH2UCHU[CH2UCHU]nUCH2U
| | |
CO CO CO
| | |
NH2 NH NH2
|
CH2
|
NH
|
CO
|
UCH2UCHU[CH2UCHU]nUCH2UCHU[CH2UCHU]nUCH2U
| | |
CO СO CO
| | _
NH NH2 NH2
|
CH2
|
NH
|
CO
|
UCH2UCHU[CH2UCHU]nUCH2UCHU[CH2UCHU]nUCH2U
| | |
CO CO CO
_ | |
Рис. 15. Структура полиакриламидного геля.
Ультрогели серии А – сферические агарозные сорбенты, мало чем отличающиеся от сефарозы, в то время как ультрогели серии АсА («acrylamide-agarose»), получаемые за счет полимеризации сетки акриламидного геля внутри жесткого каркаса агарозы, обладают дополнительной жесткостью при сохранении возможности фракционирования относительно низкомолекулярных веществ. Жесткость сорбента дает им преимущества перед биогелями серии Р, однако для них сохраняются ограничения работы при повышенной температуре, свойственные агарозе.
Toyopearl HW – полужесткий гель (TSK) японской фирмы «Toyo-Soda», представляющий собой сферические гранулы сополимера этиленгликоля и метакрилата, содержащего много гидроксильных групп. Этот гель существенно отличается от гелей на основе декстрана, агарозы и полиакриламида своей механической устойчивостью, что позволяет заполнять им колонки под давлением (с помощью перистальтического насоса), а также элюировать вещества с достаточно высокой скоростью. Носители Toyopearl химически устойчивы к кислой и щелочной среде.
Одним из существенных недостатков TSK-гелей является то, что большое количество гидроксильных групп способствует образованию водородных связей между носителем и разделяемыми белками, вызывая неспецифическую сорбцию некоторых из них на геле. Однако это свойство носителя можно использовать для очистки некоторых белков на TSK-гелях (например, HW-65fine) по типу адсорбционной хроматографии.
Частичная сорбция белков (и как следствие – замедление их элюции) возможна не только на TSK-гелях, но и на других носителях.
Наиболее подходящими для фракционирования белков являются сефадексы G-75¸200, биогели Р 60¸200, ультрагели серии АсА 34¸54 и т.д. По возможности следует выбирать сорбенты с гранулами наименьших размеров (для сефадексов, например, это категории «Fine» и «Superfine», поскольку для таких носителей быстрее наступает равновесие между подвижной и неподвижной фазами. Однако возможная скорость тока раствора через колонку с такими носителями меньше, чем для сорбента с более крупными гранулами. Кроме того, при выборе носителя следует учитывать возможность сорбции белков на матрице геля.
2.4. Подготовка носителя к работе. Если носитель представляет собой водную суспензию (сефарозы, ультрогели АсА, биогели серии А), его подготовка к работе сводится к удалению консервирующих добавок и уравновешиванию буфером (или другим раствором). Сухие носители (сефадексы, биогели серии Р) должны хорошо набухнуть в воде или буфере. Для этого нужное количество сухого геля при перемешивании высыпают тонкой струйкой в стакан с жидкостью (не наоборот, т.к. могут образоваться комки). Пользоваться для перемешивания магнитной мешалкой не следует, т.к. гранулы могут разрушиться. Время набухания гелей в водных растворах различно и зависит от величины его пор (для набухания сефадексов G-10 - G-50 при комнатной температуре требуется 3 часа, G-75 - сутки, и т.д.). Ускорить процедуру набухания можно нагреванием.