Репликация хромосомной ДНК у бактерий играет ключевую роль в их жизненном цикле. В ходе этого процесса микроорганизмы редуплицируют свой геном, а образовавшиеся дочерние геномы далее переходят в дочерние клетки. Высокая точность, с которой бактерии осуществляют такие процессы, указывает на наличие специальных механизмов их координации и контроля.
Структура области начала репликации oriC. Хромосома E. coli содержит единственную область начала репликации (origin), названную oriC, на которой происходит инициация репликации (рис. I.47, а). Размер минимальной области начала репликации, обеспечивающей автономную репликацию хромосомы, составляет 258 п.о. (положение 11–268 на рис. I.47). Сравнение первичных структур областей начала репликации различных энтеробактерий показало, что их последовательности представлены короткими консервативными участками, которые перемежаются дивергировавшими сегментами ДНК, длины которых, однако, высококонсервативны. Консервативные участки оказались сайтами связывания регуляторных белков, разделенных спейсерными последовательностями. OriC содержит пять консенсусных 9-нуклеотидных сайтов связывания инициатора DnaA (непалиндромные повторы), названных DnaA-боксами. У всех энтеробактерий области начала репликации содержат 9–14 сайтов GATC, положение восьми из которых консервативно.
В левой части oriC находится AT-богатая область, содержащая три похожих последовательности длиной в 13 нуклеотидов, каждая из которых начинается с GATC. Здесь же локализован AT-кластер, который вместе с левой 13-нуклеотидной последовательностью образует область нестабильной спирали ДНК (ДНК-расплетающий элемент). Этот участок ДНК может быть заменен без потери функции на аналогичный по нуклеотидному составу, но с другой последовательностью нуклеотидов.
OriC содержит сайты связывания белков, изгибающих ДНК, IHF (integration host factor) и FIS (factor for inversion stimulation). Оба белка, по-видимому, помогают инициатору DnaA раскручивать ДНК.
Димерный белок IciA, состоящий из субъединиц с молекулярной массой 33 кДа, специфически связывается с AT-богатыми 13-мерными повторами. Функция этого белка неизвестна, так же как и функция белка Rob, который специфически взаимодействует с 26-нуклеотидным сайтом в правой части DnaA-бокса R4. ДНК вблизи Rob-сайта обнаруживает изгиб, который более ярко выражен у молекул, полностью метилированных Dam-метилтрансферазой (см. ниже). С такими полностью метилированными ДНК взаимодействует гистоноподобный белок H-NS, сайт связывания которого перекрывается с Rob-сайтом. Это взаимодействие оказывает влияние на функционирование oriC.
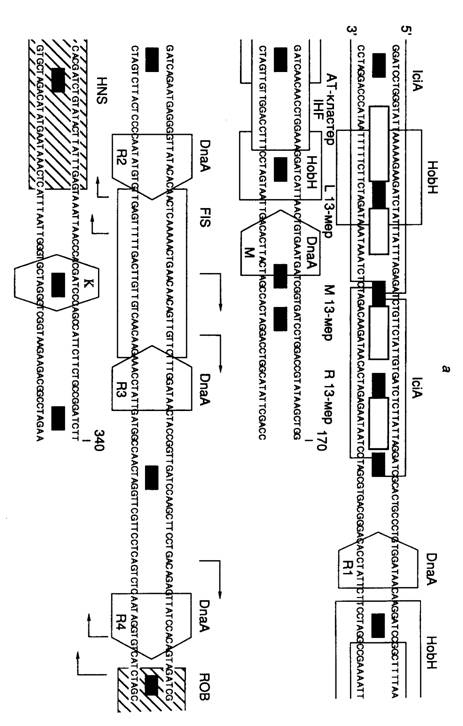
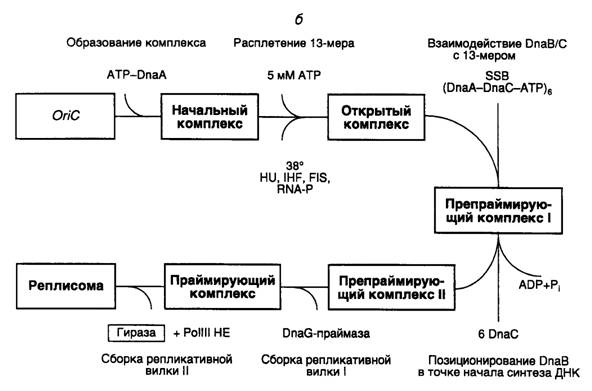
Рис. I.47. Структура области начала репликации хромосомы E. coli (а) и схема инициации ее репликации (б)
HobH – белок, взаимодействующий с метилированной по одной цепи ДНК области начала репликации (hemimethylated origin binding)
Функции белка DnaA. Белок DnaA играет ключевую роль в сборке реплисомы – многокомпонентного белкового комплекса, осуществляющего двунаправленный синтез ДНК. Белок распознает область начала репликации и привлекает к месту сборки остальные белковые компоненты реплисомы.
Этапы инициации синтеза ДНК на oriC. Сборка исходного комплекса начинается с взаимодействия белка DnaA с DnaA-боксами R1–R4 и M (см. рис. I.47, б). Для успешного прохождения последующих этапов сборки реплисомы белок DnaA должен находиться в комплексе с ATP и взаимодействовать с сверхспирализованным oriC. С помощью электронного микроскопа исходный комплекс обнаруживается в виде компактной эллипсоидной структуры, содержащей ~20 мономеров DnaA, которая закрывает oriC. Исходный комплекс обладает высокоупорядоченной структурой.
В присутствии ATP в высокой концентрации (5 мМ) исходный комплекс превращается в открытый комплекс. В этом комплексе происходит частичное расплетение АТ-богатых 13-нуклеотидных повторов, расположенных в левой части oriC. При 37° или выше единственный белок DnaA может обеспечивать расплетение ДНК. Для образования открытого комплекса при более низких температурах требуется участие структурирующего белка HU или интеграционного фактора бактерии-хозяина IHF. В открытом комплексе обнаруживают небольшие участки расплетенной ДНК в правой части oriC между DnaA-боксами R2 и R4, которые рассматривают как места посадки хеликазы.
Белок DnaB является хеликазой репликативной вилки и входит в открытый комплекс с образованием препраймирующего комплекса I, взаимодействуя с одноцепочечными участками частично расплетенной ДНК. Такие участки подготавливаются белком DnaA, который вытесняет SSB-белок с соответствующих сайтов. DnaB входит в препраймирующий комплекс I в виде гексамеров, образовавших комплекс с шестью мономерами DnaC, каждый из которых связывает одну молекулу ATP. В этом комплексе хеликазная активность белка DnaB блокирована. Освобождение DnaC из комплекса происходит в результате гидролиза ATP. Следствием этого является активация хеликазы DnaB и ее правильное расположение в комплексе. Совокупность этих событий превращает препраймирующий комплекс I в препраймирующий комплекс II.
Хеликаза должна начать функционировать в месте старта репликативной вилки в правой части oriC вблизи DnaA-боксов R2, R3 и R4. Для этого она должна быть транслоцирована от места ее первоначального вхождения в комплекс к точке начала репликации. Предполагается, что транслокация ассоциирована с ATP-зависимым освобождением из комплекса белка DnaC, что сопровождается активацией хеликазы.
В праймирующем комплексе хеликаза DnaB взаимодействует с DnaG-праймазой, которая играет ключевую роль в обеспечении инициации репликации именно на oriC. Оба этих фермента обеспечивают сопряжение функционирования двух репликативных вилок, движущихся в противоположные стороны. В бесклеточной системе при низких концентрациях праймазы репликация становится однонаправленной и может инициироваться не на oriC. В праймирующем комплексе присутствие белка DnaA больше не требуется, и он после освобождения из комплекса может быть повторно использован для инициации репликации на другом oriC. Полагают, что во время координированной сборки двух репликативных вилок в одной из них синтезируется праймер, который становится затравкой при синтезе ведущей цепи другой репликативной вилкой, движущейся в противоположном направлении. Праймаза в праймирующем комплексе функционирует по дистрибутивному механизму. После синтеза праймеров она покидает репликативную вилку и заменяется новой молекулой праймазы во время образования очередного фрагмента Оказаки.
При образовании реплисомы в каждой репликативной вилке происходит ATP-зависимое формирование димерного комплекса холофермента ДНК-полимеразы III, связанного с 3'-концами праймеров (скользящий зажим, см. выше). Вслед за этим происходит координированная элонгация праймеров, сопровождаемая двунаправленным синтезом ведущих и отстающих цепей ДНК. В бесклеточной системе точки начала синтеза ведущих цепей локализованы в oriC вблизи DnaA-боксов R2, R3 и R4.
Механизмы контроля инициации репликации in vivo. Инициация репликации ДНК у E. coli регулируется, по крайней мере, на трех уровнях: 1) инициация синхронизирована с клеточным циклом; 2) синтез ДНК в каждой области начала репликации в клеточном цикле инициируется только один раз; 3) инициация происходит синхронно во всех областях начала репликации, присутствующих в данной бактериальной клетке. Установлено, что синтез ДНК начинается после того, как масса бактериальной клетки в расчете на одну область начала репликации достигает определенного значения, названного массой инициации (initiation mass). В качестве основного водителя ритма (пейсмекера), играющего ключевую роль в контроле инициации репликации, в настоящее время рассматривается белок DnaA.
Подавление синтеза белка in vivo сопровождается завершением уже инициированного синтеза ДНК на фоне прекращения новых раундов инициации. Возобновление синтеза белка приводит к инициации репликации после лаг-периода в одну клеточную генерацию. При наличии всех необходимых белков инициация чувствительна к рифампину – специфическому ингибитору бактериальной РНК-полимеразы, что указывает на зависимость инициации от синтеза нетранслируемой РНК.
Роль топологии oriC в инициации репликации. Топоизомераза I и топоизомераза II (ДНК-гираза) поддерживают бактериальную хромосому в негативно суперскрученном состоянии. Приблизительно половина супервитков нейтрализуется гистоноподобными белками HU, IHF и FIS, тогда как остающаяся сверхспирализация бактериальной хромосомы облегчает транскрипцию, репликацию и сайт-специфическую рекомбинацию. Предполагается, что бактериальная хромосома состоит из 40–50 суперскрученных доменов с ~25 супервитками на 1 т.п.о. ДНК. В настоящее время отсутствуют точные данные о топологическом состоянии oriC, необходимом для инициации репликации у E. coli. Известно, что мутации в гене топоизомеразы topA супрессируют температурно-чувствительные мутации dnaA(Ts). Предполагается, что в этих мутантных штаммах топология oriC изменена таким образом, что допускает инициацию репликации при меньших внутриклеточных концентрациях белка DnaA. Кроме того, на важность определенного топологического состояния oriC для инициации указывает факт нарушения инициации у мутантных бактерий с измененным геном gyrB(Ts), кодирующим B-субъединицу ДНК-гиразы.
Активация репликации транскрипцией. В том случае, если сверхспирализация минихромосом или плазмид, содержащих oriC, недостаточна для инициации их репликации, инициация может происходить при одновременной транскрипции ДНК в окрестностях oriC. Изменение топологии oriC в этом случае может осуществляться за счет образования R-петель (ДНК–РНК-гибрида в двухцепочечной ДНК) или вследствие транскрипции, как таковой, при которой перед транскрибирующей РНК-полимеразой имеет место локальная положительная сверхспирализация ДНК, а вслед за ней – отрицательная. Это облегчает образование открытых комплексов при инициации синтеза ДНК.
Роль белка DnaA в регуляции инициации репликации. ~60 минут необходимо бактерии для репликации хромосомной ДНК, разделения дочерних хромосом и подготовки к новому делению. Следовательно, клетки со временем генерации короче этого периода (например при повышенных температурах на богатых питательных средах) должны инициировать репликацию хромосом, предназначенных для последующих делений, до завершения предыдущего раунда репликации. Таким образом, в отдельной клетке может содержаться реплицирующаяся хромосома со множественными точками начала репликации. При этом инициация репликации на множественных областях начала репликации происходит одновременно.
Сверхпродукция DnaA в бактериях приводит к резкому возрастанию частоты инициаций репликации без изменения общей скорости синтеза ДНК, что указывает на DnaA как на позитивный регулятор этого процесса. Среди моделей, объясняющих механизм регуляторного действия белка DnaA наибольшее распространение получила модель титрования DnaA. В соответствии с этой моделью весь вновь синтезируемый белок DnaA связывается (титруется) DnaA-боксами oriC хромосомы. Как только количество молекул инициатора превышает число внутриклеточных DnaA-боксов (все DnaA-боксы оказываются занятыми белком), происходит инициация синтеза ДНК. После запуска инициации на одном oriC наблюдается освобождение молекул DnaA, резкое повышение его внутриклеточной концентрации и синхронная инициация синтеза ДНК на других доступных областях начала репликации. При этом ассоциация с мембранами первой oriC защищает ее от использования в реинициации.
Роль Dam-метилирования в инициации синтеза ДНК. Как уже упоминалось выше, Dam-метилтрансфераза E. coli модифицирует остатки аденина в последовательностях 5'-GATC. В результате репликации молекула ДНК временно превращается из полностью метилированной молекулы в метилированную по одной цепи, что позволяет клетке распознавать вновь синтезированную ДНК. Расположение кластеров Dam-сайтов в oriC энтеробактерий высококонсервативно (см. рис. I.47, а). Неметилированная или наполовину метилированная плазмидная ДНК в клетках dam-мутантов не реплицируется, хотя и служит субстратом в бесклеточной системе репликации. Репликация хромосомной ДНК у dam-мутантов начинается на oriC, однако контроль репликации нарушен, что проявляется в асинхронности репликации на множественных oriC. Оказалось, что лишь наполовину метилированная, но не полностью метилированная или неметилированная oriC- ДНК специфически связывается с фракцией мембран E. coli in vitro. При этом в быстро растущих клетках ~1/3 времени генерации oriC- ДНК находится в наполовину метилированном состоянии, после чего полностью метилируется. То же самое характерно и для промотора гена инициатора DnaA, у которого метилированное наполовину состояние связано с подавлением транскрипции гена. В отличие от этого реметилирование вновь синтезированной цепи ДНК остальной части бактериальной хромосомы происходит быстро – в течение 1–2 мин. На основании такого рода данных высказывается предположение, что в не полностью метилированном состоянии вышеупомянутые последовательности экранированы бактериальными мембранами от контактов с регуляторными белками и не могут участвовать в повторном раунде инициации репликации (период эклипса). Мутации в гене seqA резко уменьшают время эклипса, что проявляется в асинхронности инициаций репликации. Белок SeqA оказался негативным регулятором инициации репликации, действующим на этапе взаимодействия oriC с бактериальными мембранами.
Роль белка SeqA в регуляции репликации бактериальных хромосом. Ген seqA кодирует белок длиной в 181 аминокислотный остаток, инактивация которого летальна для бактериальных клеток. Исследование взаимодействия этого белка с неметилированной, частично и полностью метилированной областями начала репликации методом смещения полос при электрофорезе в полиакриламидном геле показало его предпочтительное связывание с частично метилированными последовательностями. Однако для полной (контекст-зависимой) специфичности его взаимодействия требуется присутствие дополнительных факторов. Действительно, в составе ДНК-белковых комплексов, образованных с участием частично метилированных последовательностей oriC, обнаружен белок с молекулярной массой 24 кДа, который специфически взаимодействует с метилированной цепью ДНК в oriC. Скрининг клонотеки последовательностей E. coli позволил клонировать ген hobH (hemimethylated origin binding), кодирующий этот белок. Мутации по данному гену приводили к частичной утрате бактериальными клетками синхронизации в инициациях репликации, что также косвенно указывает на участие белка HobH в регуляции инициации репликации бактериальных хромосом на ранних стадиях клеточного цикла. Однако истинная роль этого белка в репликации окончательно не известна.
Период эклипса может заканчиваться в результате постепенного завершения метилирования частично метилированной последовательности oriC, находящейся в комплексе с мембранами. Полное метилирование этих последовательностей предотвращает их взаимодействие с мембранами и делает доступными для инициатора DnaA.
Терминация репликации. Встреча двух репликативных вилок в конце цикла репликации бактериальной хромосомы сопровождается несколькими событиями, которые необходимы для полного разделения двух образовавшихся бактериальных хромосом до деления клетки. Движение репликативных вилок навстречу друг другу сопровождается гомологичной рекомбинацией между дочерними хроматидами. В том случае, если количество произошедших рекомбинаций нечетное, образуется димер бактериальной хромосомы, тогда как при четном числе рекомбинаций – две катенированные (зацепленные друг за друга) хромосомы. Во втором случае разделение катенанов с помощью топоизомеразы IV приводит к полному разделению дочерних хромосом, тогда как в случае димера бактериальной хромосомы этого недостаточно. Разделение димера с образованием мономеров происходит в результате сайт-специфической рекомбинации в локусе dif под действием резольвазы (сайт-специфической рекомбиназы) XerCD.