Многие клетки прокариот в дополнение к основной хромосоме содержат небольшие внехромосомные ДНК, называемые плазмидами. Плазмиды, размеры которых варьируют от нескольких тысяч до сотен тысяч пар оснований, а число копий на клетку – от одной до нескольких сотен, способны к автономной (независимой от основной хромосомы) репликации и стабильно наследуются в ряду клеточных поколений. Хотя многие плазмиды дают клеткам-хозяевам ощутимые селективные преимущества (устойчивость к антибиотикам, тяжелым металлам и т.п.), большинство из них являются криптическими, т.е. не проявляющимися в видимом фенотипе клеток. Поскольку их существование – это весомая нагрузка на метаболизм клеток-хозяев, остается непонятным смысл их эволюционной стабильности. Несмотря на то что в природных условиях бактериальные клетки, по-видимому, не испытывают давления отбора, направленного на сохранение плазмид внутри клеток, последние с помощью тонких механизмов, регулирующих число их копий в клетках, стабильно сегрегируют между дочерними бактериальными клетками.
Область начала репликации небольшой плазмиды ColE1, несущей гены устойчивости к колицинам, традиционно используется в генной инженерии при конструировании векторных молекул ДНК, которые находят применение для клонирования и экспрессии в клетках E. coli коротких последовательностей нуклеотидов. Именно поэтому целесообразно рассмотреть механизмы контроля репликации плазмиды ColE1.
Инициация репликации плазмиды ColE1. Репликация плазмиды ColE1 происходит в одном направлении (однонаправленная репликация) с использованием репликативного аппарата клетки-хозяина. Сама по себе плазмида не кодирует ни одного фермента, который требовался бы для ее репликации. Область начала репликации содержит два промотора, один из них обеспечивает синтез РНК-праймера (РНК II), необходимого для инициации репликации плазмиды. Синтезированная РНК II, длина которой зависит от типа реплицируемой плазмиды, далее подвергается процессингу с помощью РНКазы H с образованием РНК длиной в 550 нуклеотидов. Эта молекула эффективно используется ДНК-полимеразой I в качестве праймера при синтезе ведущей цепи ДНК. В отсутствие РНКазы H затравкой во время репликации служит 3’-конец РНК II, хотя и с меньшей эффективностью. В клетках, дефектных по РНКазе H и ДНК-полимеразе, инициация репликации ColE1 осуществляется ДНК-полимеразой III с участием РНК II по механизму, подробно рассмотренному выше.
Все три механизма инициации репликации плазмиды основаны на уникальном свойстве РНК II образовывать стабильный ДНК–РНК-гибрид в области начала репликации. Действительно, обычные транскрипты освобождаются из транскрипционного комплекса после завершения транскрипции и отделения РНК-полимеразы от матрицы, чего не происходит с РНК II. Анализ мутантов плазмиды, дефектных по репликации, а также их ревертантов показал, что в стабильном гибриде РНК II с матрицей происходит взаимодействие между G-богатой петлей РНК II, образованной 265 нуклеотидами выше точки инициации репликации (положение –265), и С-богатым участком ДНК, расположенным в окрестностях нуклеотида –20 (рис. I.48, а). Обе эти последовательности оказались консервативными у родственных плазмид pMB1, p15A и KSF1030. Взаимодействия между указанными последовательностями, по-видимому, происходят в тот момент, когда РНК-полимераза еще находится в транскрипционном комплексе и цепи ДНК в окрестностях комплекса расплетены. Равновесие между двумя альтернативными конформациями РНК II является критическим в определении доли молекул РНК, остающейся в ДНК–РНК-гибриде, необходимом для инициации репликации плазмиды. Выбор между двумя альтернативными конформациями РНК II определяется первичной структурой участка, расположенного между нуклеотидами –359 и –380 (последовательность b) (см. рис. I.48, б). Эта последовательность может взаимодействовать с выше расположенной комплементарной последовательностью a (структура ab) или с гомологичной последовательностью g, расположенной ниже (структура bg). После того как РНК-полимераза транскрибирует первые 200 нуклеотидов, образовавшаяся РНК II формирует временную вторичную структуру, для которой характерно наличие трех доменов типа "стебель–петля" (I, II и III). Удлинение РНК II еще на несколько нуклеотидов приводит к разрушению стебля III и образованию стебля IV, который стабилизируется в результате комплементарных взаимодействий между последовательностями a и b. В течение последующей элонгации РНК II у нее возникают две альтернативные возможности формировать свою вторичную структуру. Выбор в пользу той или иной конформации зависит от того, останется ли последовательность b связанной с последовательностью a или же образует новые контакты с g-последовательностью. Переход от комплементарных пар ab к bg сопровождается сильными изменениями конформации РНК II, которые в конечном счете определяют ее способность служить праймером при репликации плазмиды. Молекулы РНК II в конформации ab могут образовывать РНК–ДНК-гибрид, служащий субстратом для РНКазы H, а в конформации bg такой способностью не обладают. Предложенная модель подтверждается, прежде всего, тем, что мутации, делающие предпочтительным образование конформации bg из-за дестабилизации стебля IV, затрудняют функционирование РНК II в качестве праймера и приводят к понижению числа копий плазмиды ColE1 внутри бактериальных клеток. Такие мутантные плазмиды, дефектные по репликации, активизируются в результате супрессорных мутаций, стабилизирующих стебель IV. Таким образом, инициация репликации плазмиды ColE1 зависит от способности РНК II образовывать РНК–ДНК-гибрид вблизи точки начала репликации (ori). При этом на образование гибрида оказывают влияние вторичная и третичная структуры выше расположенной последовательности нуклеотидов предшественника праймера.
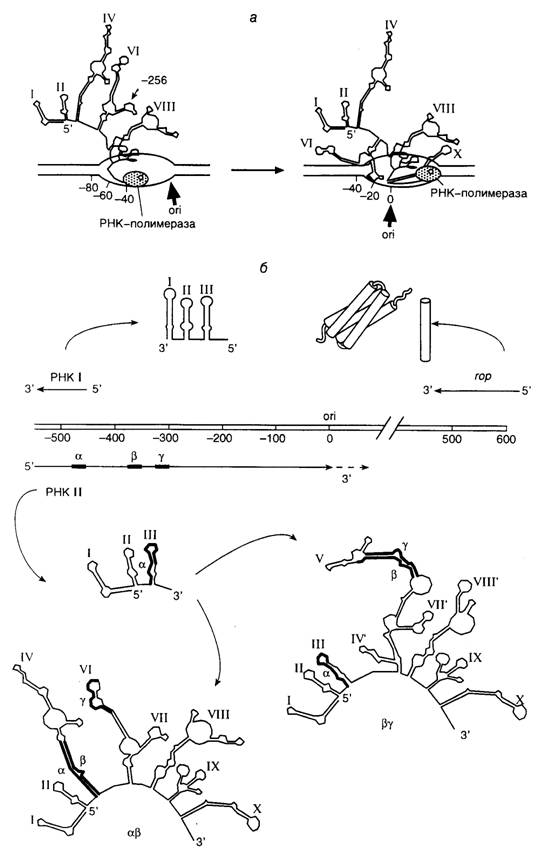
Рис. I.48. Схема регуляции репликации плазмиды ColE1
а – предполагаемая вторичная структура РНК II, после транскрибирования РНК-полимеразой ~ 500 нуклеотидов ДНК плазмиды; дальнейшее удлинение РНК II сопровождается образованием ДНК–РНК-гибрида (жирная стрелка) между РНК II и транскрибируемой ДНК;
б – возможный механизм контроля репликации плазмиды. В верхней части рисунка изображена генетическая карта участка ДНК, необходимого для инициации репликации плазмидной ДНК и ее контроля. Схематически представлены пространственные структуры двух ингибиторов репликации плазмиды: РНК I и белка Rop. В нижней части изображены две альтернативные конформации РНК II, образующиеся под действием РНК I, I–X – элементы вторичной структуры
Контроль числа копий плазмиды ColE1. Контроль инициации репликации плазмиды ColE1 осуществляется главным образом на уровне изменения пространственной структуры РНК II. Поскольку плазмиды контролируют собственный биосинтез, т.е. их репликация проходит по аутокаталитическому механизму, было постулировано, что инициация репликации ColE1 находится под влиянием ингибитора, кодируемого плазмидой, концентрация которого в клетке тем выше, чем больше число внутриклеточных копий плазмиды. Действительно, анализ механизмов репликации мутантных плазмид, для которых характерна высокая копийность, позволил выявить два транс- действующих фактора, кодируемых плазмидой и оказывающих влияние на репликацию плазмиды in vivo.
Основным ингибитором репликации оказалась небольшая РНК длиной в 108 нуклеотидов, названная РНК I, полностью комплементарная 5’-концевой последовательности предшественника праймера (РНК II). Промотор гена РНК I расположен в области начала репликации плазмиды ColE1 и направлен в противоположную сторону по отношению к промотору РНК II (см. рис. I.48). Комплементарные взаимодействия между РНК I и РНК II оказывают влияние на образование пространственной структуры РНК II таким образом, что предпочтительно возникает конформация βγ, неактивная в отношении инициации репликации (см. рис. I.48, б, внизу справа).
Взаимодействие между РНК I и РНК II происходит продуктивно лишь до тех пор, пока синтезируется короткий транскрипт РНК II длиной не более 80 нуклеотидов. Хотя взаимодействие РНК I с такой короткой последовательностью нуклеотидов происходит медленнее, чем с транскриптом длиной в 360 нуклеотидов, в последнем случае РНК I не оказывает влияния на конформацию 5’-концевой части РНК II и на ее способность функционировать в качестве затравки при репликации плазмиды (конформация αβ, рис. I.48, б, внизу слева). Из этого ясно, что скорость образования гибридов между РНК I и РНК II является определяющей для эффективного функционирования механизма регуляции репликации плазмиды. Процесс взаимодействия РНК I и РНК II в настоящее время детально изучен. Он проходит через образование нескольких промежуточных продуктов и завершается получением стабильного гибрида между полностью комплементарными друг другу РНК I и 5’-концевой областью РНК II.
РНК-организующий белок Rop. Ген второго компонента, негативно регулирующего репликацию плазмиды ColE1, картирован непосредственно за областью начала репликации. Этот ген кодирует 63-звенный белок, названный Rop (repressor of primer), существующий в растворе в виде димера. Как in vivo, так и in vitro Rop усиливает ингибирующую активность РНК I, не оказывая влияния на синтез РНК II. При этом Rop влияет на начальные фазы взаимодействия РНК I и РНК II, облегчая переход очень нестабильного промежуточного продукта С* в более стабильный – Сm*. Белок Rop обладает высоким сродством к С* и лишь слабо взаимодействует с изолированными РНК I и РНК II in vitro. Предполагают, что Rop проявляет незначительную специфичность в отношении последовательностей нуклеотидов и распознает некоторые общие особенности структуры комплекса РНК I–РНК II, возникающего на ранних этапах их взаимодействия. Таким образом, функции белка Rop, по-видимому, заключаются в преобразовании нестабильного комплекса РНК–РНК в более стабильный, что, в свою очередь, сопровождается подавлением формирования праймера, необходимого для инициации репликации плазмиды ColE1.
Использование антисмысловых РНК в контроле репликации бактериальных плазмид является распространенным приемом. В частности, репликация небольшой, низкокопийной плазмиды R1 контролируется белком RepA, который участвует в инициации репликации плазмиды в качестве позитивного регуляторного фактора. Синтез RepA, в свою очередь, регулируется посттранскрипционно с помощью небольшой антисмысловой РНК CopA, которая связывается с RepA-мРНК в результате многоступенчатой реакции, напоминающей образование гибрида между РНК I и РНК II, рассмотренное выше. Такое взаимодействие подавляет экспрессию гена repA, возможно, вследствие расщепления РНК–РНК-дуплекса РНКазой III. Внутриклеточная концентрация антисмысловой CopA-РНК прямо пропорциональна числу копий плазмиды R1. Аналогичный механизм описан и для регуляции инициации репликации плазмиды pT181 Staphylococcus aurеus.
При получении бактериальных векторов для генной инженерии, многие из которых содержат область начала репликации плазмиды ColE1, с целью повышения числа их копий в бактериальных клетках часто используют ингибиторы биосинтеза белка, в частности хлорамфеникол. После обсуждения механизмов регуляции контроля репликации этой плазмиды становятся понятными принципы, на которых основан данный прием. Действительно, внесение в культуральную среду хлорамфеникола блокирует биосинтез бактериальных белков, в том числе, и белка Rop, который необходим для эффективного подавления инициации репликации плазмиды под действием РНК I. В результате нарушается контроль копийности плазмид в бактериальных клетках, и они начинают непрерывно реплицироваться, используя для этой цели предварительно синтезированные бактериальные белки.
Известно, что две фенотипически различающиеся плазмиды, использующие одинаковый механизм контроля репликации, несовместимы в одной бактериальной клетке. Клетки, содержащие две плазмиды из разных групп совместимости, в процессе размножения быстро образуют две популяции, каждая из которых содержит только один тип плазмид. Это происходит вследствие случайного выбора плазмид для репликации внутри бактериальных клеток и случайного распределения исходного пула плазмид по дочерним клеткам. Эволюционное возникновение механизма контроля репликации бактериальных плазмид с использованием антисмысловых РНК расширило возможности появления плазмид, принадлежащих к разным группам совместимости и сосуществующих в одних и тех же бактериальных клетках. Действительно, несмотря на использование одного и того же механизма, антисмысловые РНК, обладающие разными последовательностями нуклеотидов, не смогут узнавать "чужие," гетерологичные РНК-мишени. Это позволяет таким плазмидам сосуществовать в одной бактериальной клетке и создает условия для их более широкого распространения в природных популяциях микроорганизмов.