ПОЛУЧЕНИЕ АММОНИЙНОЙ СЕЛИТРЫ.
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЕЙ КАЧЕСТВА
АММОНИЙНОЙ СЕЛИТРЫ
Учебно-методическое пособие
Киров 2014
УДК 661.5 (07)
М 69
Допущено к изданию методическим советом химического факультета ФГБОУ ВПО «ВятГУ» в качестве учебно-методического пособия для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ» всех форм обучения
Рецензент:
зав. кафедрой НиФХ ФГБОУ ВПО «ВятГУ»,
кандидат химических наук
Ю.Н.Ушакова
Михайлова, И.Ю.
М 69 Получение аммонийной селитры. Определение показателей качества аммонийной селитры. Учебно-методическое пособие / И. Ю. Михайлова. – Киров: ФГБОУ ВПО «ВятГУ», 2014. – 25 с.
УДК 661.5 (07)
Учебно-методическое пособиепредназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ», всех форм обучения для выполнения лабораторных работ по дисциплине «Химическая технология неорганических веществ».
Тех. редактор Е. В. Кайгородцева
 © ФГБОУ ВПО «ВятГУ», 2014
© ФГБОУ ВПО «ВятГУ», 2014
СОДЕРЖАНИЕ
ВВЕДЕНИЕ. 4
1. ПОЛУЧЕНИЕ АММОНИЙНОЙ СЕЛИТРЫ.. 5
1.1. Методы получения. 5
1.2. Упаривание растворов аммонийной селитры.. 8
1.3. Кристаллизация (гранулирование) аммонийной селитры.. 8
1.4. Обработка гранул для предотвращения слёживания. 9
1.5. Сушка аммонийной селитры.. 10
1.6. Упаковка, хранение, транспортировка аммонийной селитры.. 10
2. ПРИМЕНЕНИЕ АММОНИЙНОЙ СЕЛИТРЫ.. 11
3. ВЫПОЛНЕНИЕ РАБОТЫ.. 14
3.1. Получение аммонийной селитры.. 14
3.2. Определение содержания NH4NO3 18
3.3. Определение массовой доли воды, гранулометрического состава и статической прочности гранул аммонийной селитры.. 20
3.4. Определение значения рН раствора аммонийной селитры.. 21
3.5. Определение рассыпчатости продукта. 21
3.6. Определение насыпного веса продукта. 21
4. КОНТРОЛЬНЫЕ ВОПРОСЫ.. 22
5. ТРЕБОВАНИЯ К ОТЧЕТУ О ЛАБОРАТОРНОЙ РАБОТЕ. 24
6. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ.. 24
ВВЕДЕНИЕ
Нитрат аммония, аммонийная (аммиачная) селитра (NH4NO3) –соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Физические свойства. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении – 235 °C. Молекулярная масса 80,04 а. е. м.. Скорость детонации 2570 м/с.
Термическое разложение. Аммонийная селитра – окислитель, способный поддерживать горение. При нагревании ее в замкнутом пространстве, когда продукты терморазложения не могут свободно удаляться, селитра может при некоторыхусловиях взрываться (детонировать). Она может взрываться также под воздействием сильных ударов, например при инициировании взрывчатыми веществами. Термическое разложение аммонийной селитры в зависимости от температуры (табл.1) происходит по-разному.
Таблица 1
| Температура: | Реакция: |
| 110 °С и выше | NH4NO3→ NH3 + НNО3 –174,4 кДж/моль (эндотермическая) 1 |
| 200–270 °C | NH4NO3→ N2O + 2H2O +36,8 кДж/моль (слабо-экзотермическая) 2 |
| выше 270 °C, детонация | NH4NO3→ N2 + ½O2 + 2H2O + 118 кДж/моль (экзотермическая) 3 |
По реакции 3 тепло взрыва должно бы составить 1,48 МДж/кг. Однако вследствие протекания побочных реакций, одна из которых эндотермическая 1, фактическое тепло взрыва составляет 0,96 МДж/кг и по сравнению с теплом взрыва гексогена (5,45 МДж/кг) мало. Однако для крупнотоннажного продукта как аммонийная селитра учет его взрывчатых свойств (хотя и слабых) имеет значение для обеспечения безопасности.
Растворимость нитрата аммония в воде в зависимости от температуры представлена в табл.2.
Таблица 2
| Температура, °C | ||||||
| Растворимость, г/100 мл |
При растворении соли происходит сильное поглощение тепла, что значительно замедляет ее растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Аммонийная селитра хорошо растворима в воде, этиловом и метиловом спиртах, пиридине, ацетоне, жидком аммиаке.
Содержание элементов в нитрате аммония в массовых процентах:
O – 60 %, N – 35 %, H – 5 %.
1. ПОЛУЧЕНИЕ АММОНИЙНОЙ СЕЛИТРЫ[1-3]
Технологический процесс производства аммонийной селитры состоит из следующих основных стадий:
1) получение нитрата аммония;
2) упаривание раствора соли до состояния плава;
3) кристаллизация (гранулирование) соли из плава;
4) обработки гранул поверхностно-активными веществами;
5) сушка или охлаждение соли;
6) упаковка, хранение и погрузкааммонийной селитры;
7) очистка газовых выбросов и сточных вод.
Методы получения
Основной метод. В промышленном производстве используются безводный аммиак и концентрированная азотная кислота:
HNO3 + NH3 → NH4NO3 + 144,9 кДж 4
Необратимая гетерогенная реакция протекает бурно с выделением большого количества тепла, лимитируется растворением газа в жидкости.Для уменьшения диффузионного торможения большое значение имеет перемешивание реагентов.
Реакцию проводят при температуре 180-200 °С, давлении близком к атмосферному. Интенсивные условия проведения процесса в значительной мере обеспечиваются конструкцией аппарата (рис. 1).
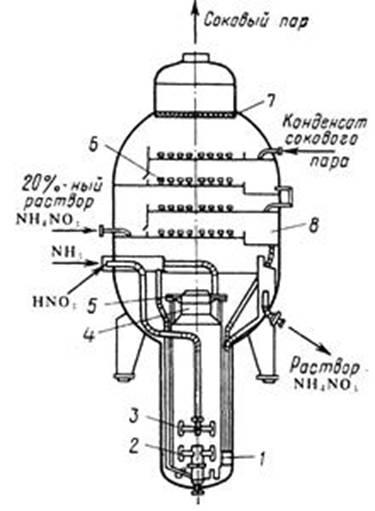
Рис.1. Аппарат ИТН:
1 – реакционный стакан; 2 – барботер аммиака; 3 – барботер азотной кислоты; 4 – диффузор; 5 – завихритель; 6 – колпачковая тарелка; 7 – брызгоотбойник; 8 – промыватель
Реактор представляет собой вертикальный цилиндрический аппарат, состоящий из реакционной и сепарационной зон. В реакционной зоне имеется стакан 1, в нижней части которого расположены отверстия для циркуляции раствора. Выше отверстий внутри стакана размещен барботер 2 для подачи газообразного аммиака, над ним – барботер 3 для подачи азотной кислоты. Реакционная парожидкостная смесь выходит из верхней части реакционного стакана; часть раствора выводится из аппарата ИТН и поступает в донейтрализатор, а остальная часть (циркуляционная) вновь идет вниз. Выделившийся из парожидкостной смеси соковый пар отмывается на колпачковых тарелках 6 от брызг раствора аммиачной селитры и паров азотной кислоты 20 %-м раствором селитры, а затем конденсатом сокового пара.
Теплота реакции 4 используется для частичного испарения воды из реакционной смеси, отсюда и название аппарата – ИТН (использование теплоты нейтрализации). Разница в температурах в разных частях аппарата приводит к более интенсивной циркуляции реакционной смеси.
Метод Габера. По способуГабераиз азота и водорода (при давлении, температуре и катализаторе) синтезируется аммиак (реакция 5), часть которого окисляется до азотной кислоты (реакция 6) и реагирует с аммиаком, в результате чего образуется нитрат аммония (реакция 7):
3H2 + N2 → 2NH3, 5
NH3 + 2O2 → HNO3 + H2O, 6
HNO3 + NH3 → NH4NO3. 7
Нитрофосфатный или способ Одда, названный в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из доступного природного сырья. При этом протекают следующие процессы:
ü Природный фосфат кальция растворяют в азотной кислоте:
Ca3(PO4) + 6HNO3 + 12H2O → 2H3PO4 + 3Ca(NO3)2 + 12H2O. 8
ü Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата – Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
ü На нитрат кальция и неудаленную фосфорную кислоту действуют аммиаком, в итоге получают нитрат аммония:
Ca(NO3) + 4H3PO4 + 8NH3 → CaHPO4↓ + NH4NO3+ 2(NH4)2HPO4 . 9
Упаривание растворов аммонийной селитры
Из аппарата ИТН выходит растворNH4NO3 с концентрацией 60 - 80 %. Во избежание коррозии выпарных аппаратов и потерь азота – свободную азотную кислоту в растворе нейтрализуют аммиачной водой в донейтрализаторе. В выпарных аппаратах лишняя вода выпаривается до состояния плава, в котором содержание нитрата аммония составляет 94,5 - 98,5 % в зависимости от сорта готового продукта, способа дальнейшей кристаллизации или гранулирования.