Приборы, оборудование, материалы и реактивы:
ü установка для получения аммонийной селитры: магнитная мешалка с одновременным нагревом и поддержанием температуры, водяная баня, фторопластовый стакан емкостью 0,5 л, термометр, капельная воронка объемом 100 мл, обратный холодильник;
ü фарфоровая чашка для выпаривания;
ü электронные весы;
ü мерные цилиндры на 25, 50 мл, пипетка на 10 мл, мерная колба на 250 мл, бюретки.
ü растворы: азотной кислоты (40–50 %-й), водного аммиака (25 %-й), NaOH (0,1 н), формалина (40 %);
ü индикаторы: фенолфталеин, универсальная индикаторная бумага.
Выполнение работы.
Перед началом работы проверяют концентрацию азотной кислоты и аммиака. Для этого их растворы осторожно наливают в цилиндры и при помощи ареометров определяют плотность. Затем по справочнику находят процентное содержание азотной кислоты и аммиака в этих растворах.
По уравнению реакции 4 в зависимости от заданного преподавателем количества и концентрации HNO3 рассчитывают необходимое для ее нейтрализации количество водного аммиака.
Для получения аммонийной селитры используют лабораторную установку, схема которой представлена на рис. 3.
Мерным цилиндром отмеряют количество азотной кислоты и помещают ее в реактор 1. Включают магнитную мешалку 3, пускают холодную воду в рубашку обратного холодильника 5. В капельную воронку 4 заливают отмеренное мерным цилиндром рассчитанное количество 25 % раствора аммиака, которое приливают в реактор 1 порциями по 5 мл каждые 5 минут. Процесс нейтрализации сопровождается повышением температуры. В момент приливания аммиака контролируют изменение температуры термометром 6. Во время опыта с помощью индикаторной бумаги контролируют рН раствора в реакторе. При достижении значения рН 7–8 опыт заканчивают.
Далее раствор аммонийной селитры переливают в предварительно взвешенную фарфоровую чашку и упаривают воду из раствора на установке, изображенной на рис.4. Упаривание проводят при перемешивании в интервале температур 70–100 °С.
После упаривания проводят сушку аммонийной селитры в сушильном шкафу при температуре 60–80 °С в течение 1,5–2 часов.
После охлаждения аммонийной селитры взвешивают чашку и, высчитав массу полученной селитры, определяют ее выход в процентах, сравнивая полученный результат с теоретическим значением 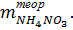
Далее определяют содержание в (%) аммонийного азота в экспериментально полученной соли NH4NO3 и гранулированном удобрении по методике, описанной в пункте 3.2.

Рис. 3. Установка для получения аммонийной селитры:
1 – реактор; 2 – водяное охлаждение; 3 – магнитная мешалка; 4 – капельная воронка; 5 – обратный холодильник; 6 – спиртовый термометр

Рис.4. Установка для упаривания аммонийной селитры:
1 – чашка для упаривания; 2 – магнитная мешалка с нагревом и поддержанием температуры; 3 – регулятор скорости вращения мешалки
Количество нитрата аммония (г) – максимально возможное, которое можно получить, определяют по формуле:
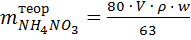 , (1)
, (1)
где 80 и 63 – молярные массы NH4NO3 и HNO3, г/моль;
V – объём HNO3, взятой на образование аммонийной селитры, см3;
ρ – плотность HNO3, г/см3;
w – содержание HNO3 в растворе, долях единицы.
3.2. Определение содержания NH4NO3 [4]
В аммонийной селитре азот содержится в аммонийной и нитратной формах, поэтому анализ на содержание азота проводят по двум составляющим на NH4+ и NO3-. Азот, находящийся в удобрении в виде NH4+, определяют простым и удобным формальдегидным методом – в одну операцию – титрованием. Однако при наличии в нитрате аммония примесей сульфата или хлорида аммония или других аммонийных солей они также включаются в определяемое количество азота. Поэтому, наряду с определением в нитрате аммония аммонийного азота по формальдегидному методу необходимо также установить содержание в нем нитратного или общего азота. Определение общего количества азота можно осуществить путем восстановления нитрата активными металлами (сплавом Деварда) или раствором хлорида железа (II).
Лабораторная работа ограничивается определением аммонийного азота формальдегидным методом.
При взаимодействии формальдегида с нитратом аммония образуется гексаметилентетраамин С6Н12N4 (уротропин) с выделением эквивалентного количества соответствующей кислоты в свободном состоянии:
4NH4NO3 + 6HCOH = С6Н12N4 + 4HNO3 + 6H2O. 10
Выделившуюся кислоту оттитровывают раствором гидроксида натрия в присутствии фенолфталеина.
Химизм процесса указывает на недопустимость содержания в соли в качестве примесей кислот и соединений, реагирующих с выделяющейся кислотой, например, карбонатов. В первом случае получатся завышенные результаты, во втором заниженные, например:
(NH4)2СO3 + 6HCOH = С6Н12N4 + 2H2СO3 + 6H2O. 11
Заниженные результаты получаются в результате разложения образующейся H2СO3 на оксид углерода (IV) и воду (в присутствии сильных кислот). Во избежание этого применяют раствор формальдегида, предварительно нейтрализованный раствором щелочи в присутствии фенолфталеина.
Выполнение работы.
Соль NH4NO3 ~ 2 г, взвешивают на аналитических весах, количественно переносят в мерную колбу емкостью 250 мл, смывая соль через воронку дистиллированной водой, доводят объем раствора в колбе водой до метки. Содержимое колбы тщательно перемешивают. Далее соль оставляют на время, в течение которого проводят нейтрализацию формальдегида.
Раствор 40%-го формальдегида (формалина) предварительно нейтрализуют для удаления примеси муравьиной кислоты. Для этого цилиндром отбирают 20 мл формалина, переносят в коническую колбу емкостью 250 мл, прибавляют 50 мл дистиллированной воды, три капли фенолфталеина и нейтрализуют 0,1 н раствором NaOH до появления слабо-малинового окрашивания.
Из приготовленного раствора соли отбирают пипеткой пробу объемом 10 мл и переносят ее в коническую колбу емкостью 250 мл с нейтрализованным раствором формалина. Добавляют три капли фенолфталеина и перемешивают в течение двух минут, после чего оттитровывают выделившуюся кислоту 0,1 н раствором NaOH до появления слабо-малиновой окраски.
Обработка результатов.
Содержание NH4NO3 в пробе в (%) вычисляют по формуле:
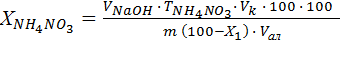 (2)
(2)
где 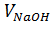 – объем 0,1 н раствора NaOH, пошедшего на титрование, см3;
– объем 0,1 н раствора NaOH, пошедшего на титрование, см3;
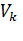 – объем приготовленного раствора селитры, 250 см3;
– объем приготовленного раствора селитры, 250 см3;
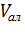 – объем аликвоты, 10 см3;
– объем аликвоты, 10 см3;
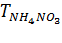 – титр NH4NO3 по 0,1н раствору NaOH, 0,008 г/см3;
– титр NH4NO3 по 0,1н раствору NaOH, 0,008 г/см3;
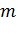 – масса аммонийной селитры, 2 г;
– масса аммонийной селитры, 2 г;
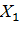 – массовая доля воды, % (определяется для гранулированной аммонийной селитры в лабораторной работе «Классификация и свойства минеральных удобрений»).
– массовая доля воды, % (определяется для гранулированной аммонийной селитры в лабораторной работе «Классификация и свойства минеральных удобрений»).
Содержание аммонийного азота в (%) в NH4NO3 вычисляют по формуле:
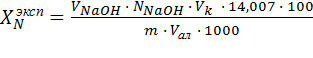 (3)
(3)
где 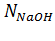 – нормальная концентрация NaOH, моль/дм3;
– нормальная концентрация NaOH, моль/дм3;
14,007 – молярная масса эквивалента азота, г/моль.
На основе значения 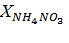 (%) делают заключение о содержании основного вещества в полученной экспериментально и гранулированной аммонийных селитрах.
(%) делают заключение о содержании основного вещества в полученной экспериментально и гранулированной аммонийных селитрах.
Полученное значение 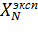 (%) сравнивают с теоретическим.
(%) сравнивают с теоретическим.
3.3. Определение массовой доли воды, гранулометрического состава и статической прочности гранул аммонийной селитры
Определение перечисленных в заголовке показателей качества аммонийной селитры марки «Б» производства Кирово-Чепецкого завода минеральных удобрений выполняется в лабораторной работе «Классификация и свойства минеральных удобрений», где одним из исследуемых удобрений должна быть аммонийная селитра.