Рак шейки матки занимает ведущее место в структуре онкологических заболеваний репродуктивной системы женщины. В связи с этим понимание механизмов развития и выявление патологических состояний шейки матки имеет важное значение. Вовремя выявленные патологические процессы в шейке матки позволяют сохранить репродуктивную функцию, избежать развитие серьезных онкологических заболеваний и в некоторых случаях даже сохранить жизнь. В мире давно известно, что в развитии рака шейки матки принимает участие вирус папилломы человека. Раннее начало половой жизни и частая смена половых партнеров увеличивают риски заражения вирусом папилломы человека. Важно отметить, что предрак и рак шейки матки зачастую протекает бессимптомно. В связи с этим, все вышеперечисленное указывает на необходимость регулярных профилактических осмотров у гинеколога, осмотр шейки матки, проведение цитологического исследования соскобов шейки матки, тестирование на наличие вируса папилломы человека. Проведение этих мероприятий позволяет врачу выработать стратегию действий и прогноз в отношении каждой женщины. Во время осмотра шейки матки, врач принимает решение о необходимости проведения кольпоскопии, взятия цитологического исследования, ВПЧ-тестов. После получения результатов в некоторых ситуациях требуется дополнительная более глубокая диагностика. Это предусматривает расширение объема диагностических мероприятий до проведения биопсии. В случае выявления тяжелых поражений шейки вплоть до рака шейки матки может быть принято решение о проведении лечебных мероприятий, начиная от эксцизии (удаление патологических участков на шейке матки с использованием электрохирургической петли) или конизации шейки матки (хирургический метод лечения, позволяющий иссечь наружную поверхность шейки матки и участок цервикального канала) до удаления матки. В некоторых случаях при легкой степени поражения шейки матки возможно периодическое наблюдение или же консервативное лечение с использованием иммуномодулирующих препаратов. Важно отметить, что проведение лечение не исключает риска повторного заражения вирусом папилломы человека. Именно поэтому профилактические осмотры должны проводиться с регулярной периодичность, не реже 1 раз в 5 лет. С другой стороны, не менее важное значение имеет проведение вакцинации от вируса папилломы человека. Целесообразно проводить вакцинацию до начала половой жизни, оптимально в возрасте 9-13 лет.
Приложение Г1
Инструкция по проведению цитологического исследование соскобов экзо- и эндоцервикса
Для получения адекватного материала необходимо:
1. Использовать современные инструменты — комбинированные щетки с эндоцервикальным компонентом или 2-мя отдельными щетками. Следует исключить из употребления все шпатели (Эйра, деревянные и металлические), кюретажные ложечки, часто входящие в одноразовый гинекологический набор, как не позволяющие получить достойный скарификат из зоны трансформации и переходной зоны и разрушающие клеточные элементы при распределении материала на стекло.
2. Получать материал в виде скарификата до «кровавой росы», чтобы был получен образец максимально богатый клетками.
3. Ввиду того, что часть повреждений может находиться за пределами эктоцервикса, полноценный цервикальный образец должен быть получен из цервикального канала и крипт эндоцервикса.

Рисунок 1. Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щеткам (А, Б), либо комбинированной щеткой с эндоцервикальным компонентом (В).
Правила забора традиционного мазка на онкоцитологию:
1. Шейку матки обнажают в зеркалах.
2. Материал берется с зоны трансформации с ее поверхности - переходной зоны стыка эпителиев и из эндоцервикальных крипт, то есть с экто- и из эндоцервикса. В связи с тем, что неопластический процесс изначально и наиболее активно развивается в месте стыка эпителиев (переходной зоне) и зоне трансформации, соскоб (мазок) обязательно должен включать эпителий этих зон. Из-за поражения эндоцервикальных крипт важно присутствие в материале эндоцервикального компонента.
3. Необходимо использование специального одноразового инструмента, гарантирующего взятие материала со всех указанных зон и обеспечивающего информативность препарата.
Использование нестандартизованных инструментов недопустимо: это приводит к снижению эффективности цитологического исследования
4. Мазок необходимо брать до проведения кольпоскопии и различных проб, бимануального исследования во избежание лизирования и деформации клеточных элементов.
5. Забор материала проводят после удаления слизи стерильным сухим мягким ватным тампоном, без грубого давления на шейку во избежание утраты эпителия.
6. Взятие материала для цитологического исследования проводится при помощи цитощётки (экзоцервикс) и эндоцервикальной щётки (эндоцервикс) и представляет собой получение соскоба-скарификата.
7. Рекомендуемая методика забора материала: цитощетку, расположенную преимущественно на экзоцервиксе, поверните 5 раз по часовой стрелке на 360° (рис. 2). Если забор материала осуществляется цитощёткой с эндоцервикальным штифтом, её рекомендуется повернуть не менее 3-х раз на 360°.

Рисунок 2. Правила забора материала для цитологического исследования цитощеткой и техника приготовления мазка.
8. Для взятия материала с эндоцервикса эндоцервикальной щеткой после введения её следует повернуть не менее трех раз против часовой стрелки (рис. 3b). Закономерно появление "кровавой росы", что свидетельствует о получении информативного цервикального образца, где, кроме слизи, присутствуют клетки практически всех слоев эпителиального пласта.
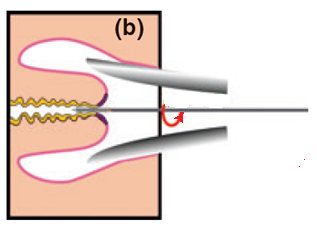
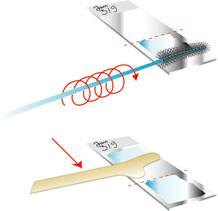
Рисунок 3. Правила забора материала для цитологического исследования эндоцервикальной щеткой и техника приготовления мазка (обязательно: щетка совершает вращательные движения).
9. Адекватный мазок должен быть максимально тонким и не должен содержать "толстые участки", включающие "непросматриваемые" скопления или комплексы клеток. Правила и варианты приготовления мазка представлены на рисунках 2 и 3.
10. Материал должен распределяться равномерно вдоль обезжиренного, сухого стекла (а не поперек или кругами) по всей поверхности стекла с равномерным распределением наибольшего количества полученного скарификата (рис. 2).
11. При использовании окраски по Романовскому-Гимзе специальные фиксаторы не применяются, препарат высушивается на воздухе.
12. Мазки должны быть маркированы: на обороте стекла препарата сбоку по короткому краю указывают фамилию пациентки, локализацию забора (экто-, эндоцервикс) и регистрационный номер исследования (рис. 2,3).
13. В Российской Федерации направление, прилагаемое к препарату, является стандартной формой N 446/у, утверждённой приказом Министерства здравоохранения Российской Федерации от 24 апреля 2003 N 174 "Об утверждении учетных форм для цитологических исследований". Необходимо заполнить все пункты лицевой стороны бланка (в графе "Проведенное лечение" обязательно указать, какое, например, ДЭК 2002 год).
Мазок не следует брать:
· ранее 48 часов после полового контакта;
· во время менструации;
· в период лечения генитальных инфекций;
· ранее 48 часов после расширенной кольпоскопии с обработкой 3-5% растворами уксусной кислоты или Люголя, после использования любрикантов, тампонов или спермицидов;
· после вагинального исследования или спринцевания.
Приложение Г2
Виды ВПЧ - тестов
1. Полимеразная цепная реакция (ПЦР) – многократное копирование определенного участка вирусной ДНК типоспецифическими и видооспецифическими праймерами – качественное определение ВПЧ ВКР с типированием вируса. Рекомендуется исследование 10-14 типов ВПЧ ВКР.
2. RT (real-time) PCR – ПЦР в реальном времени – оценивается вирусная нагрузка в логарифмах, дифференцируются клинически значимые количества ВПЧ с рисками присутствия неоплазии от малозначимых, соответствующих транзиторной и разрешившейся ВПЧ-инфекции.
3. Качественные ДНК ПЦР-тесты на 14 типов ВПЧ ВКР с частичным генотипированием особо «опасных» типов ВПЧ (16 и 18 типов и остальных). Разработаны и применяются тест системы, которые позволяют выполнить идентификацию генов ВПЧ 16, 18, 31, 45, 51, 52 и 59 типов, остальные типы ВПЧ ВКР определяются в двух группах: 33, 56, 58, 66 и 35, 39, 68 [52, 62].
4. Тест двойного гибридного захвата (Hybrid Capture II – HC2)=ВПЧ Digene-тест. Тест основан на гибридизации участков ДНК ВПЧ ВКР с РНК- зондами, улавливаемых антителами с флюоресцентной меткой. При позитивном результате указывается клинически значимая концентрация 13 типов ВПЧ ВКР, в копиях ДНК ВПЧ на 1 мл образца. Отрицательный результат теста практически исключает присутствие CIN2-3.
5. Тесты на основе обнаружения РНК ВПЧ: PreTect HPV-Proofer (амплификация мРНК Е6/Е7 пяти типов ВПЧ высокого риска (16, 18, 31, 33 и 45)) и Aptima (Gen-Probe) основан на целевом захвате и гибридизации мРНК Е7 для выявления экспрессии мРНК 14 типов ВПЧ ВКР с частичным генотипированием.