Реальные газы
Уравнение Клапейрона-Менделеева описывает идеальные газы. Ван-дер-Ваальс предложил в этом уравнении учесть собственный объем молекул и силы межмолекулярного взаимодействия:
1. Наличие сил отталкивания между молекулами приводит к тому, что фактический объем, в котором могут двигаться молекулы, равен Vm − b, где Vm - молярный объем, b - объем молекул.
2. Наличие сил притяжения между молекулами приводит к появлению дополнительного давления на газ 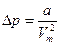 , где а - постоянная Ван-дер-Ваальса, характеризует силы межмолекулярного взаимодействия.
, где а - постоянная Ван-дер-Ваальса, характеризует силы межмолекулярного взаимодействия.
Введя эти поправки в уравнение Клапейрона-Менделеева, получим уравнение Ван-дер-Ваальса для 1 моля газа 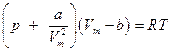
или для произвольного количества вещества μ = m/M 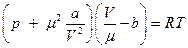 ,
,
где поправки a и b - постоянные для каждого газа величины, определяемые из эксперимента.
Теоретические изотермы реального газа приведены на рис. 1 слева, а экспериментальные изотермы реального газа приведены на рис. 1 справа.
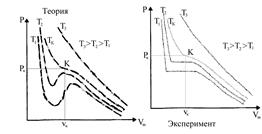
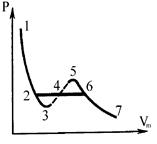
Рис. 1. Рис. 2.
При высоких температурах (T > Tк) теоретические и экспериментальные изотермы реального газа одинаковы (и мало отличаются от изотермы идеального газа).
При некоторой температуре Тк на теоретических и экспериментальных изотермах появляется точка перегиба.
Эта изотерма называется критической, а соответствующие ей температура Тк, объем Vк и давление pк, - называются критическими.
Состояние с критическими параметрами называется критическим состоянием.
При более низких температурах теоретические изотермы (докритические изотермы) имеют волнообразный участок, а экспериментальные изотермы имеют горизонтальный участок, причем длина горизонтальных участков возрастает с понижением температуры.
Для объяснения этого различия следует иметь в виду, что уравнение Ван-дер-Ваальса является уравнением третьей степени относительно V и, следовательно, оно может иметь либо три вещественных корня, либо два мнимых и один вещественный корни.
Физический смысл имеют только вещественные корни.
Все докритические изотермы (Т < Тк) описывают переход вещества из газообразного состояния в жидкое (рис. 2):
участок 7®6 соответствует газообразному состоянию (пару),
участок 6®2 соответствует переходу веществ из газообразного в жидкое состояние,
участок 2®1 соответствует жидкому состоянию,
точка 2 соответствует кипящей жидкости,
точка 6 - соответствует состоянию сухого насыщенного пара,
точки на участке 6-2 соответствует состоянию влажного пара (он является двухфазной системой, состоящей из кипящей жидкости и сухого насыщенного пара).
Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
При некоторых условиях могут быть реализованы состояния, изображаемые участками 6®5 и 3®2 - эти неустойчивые состояния (метастабильные) и называются перегретой жидкостью (участок 6®5) и пересыщенным паром (участок 3®2).
Изотерма на участках 7®6®5 и 3®2®1 при уменьшении объема V показывает возрастание давления р, что естественно.
Однако на участке 5®4®3 уменьшение объема (сжатие вещества) приводит к уменьшению давления и это означает, что при постепенном изменении объема вещество не может оставаться в виде однородной среды и в в действительности происходит распад вещества на две фазы.