Внутренняя энергия Um реального газа складывается из кинетической энергии теплового движения молекул (она равна внутренней энергии идеального газа CvT) и потенциальной энергии межмолекулярного взаимодействия  , так что
, так что 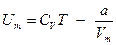 и величина Um растет с увеличением температуры и объема.
и величина Um растет с увеличением температуры и объема.
Если реальный газ адиабатически расширяется и не совершает работу (расширение газа в вакуум), то на основании первого начала термодинамики Q = D U + A получим, что U 1 = U 2, т.е. внутренняя энергия реального газа не изменяется.
Аналогичное равенство U 1 = U 2 справедливо и для адиабатического расширения в вакуум и идеального газа, однако физический смысл этого равенства различен для двух газов:
· для идеального газа оно означает равенство температур Т 1 = Т 2 (при адиабатическом расширении идеального газа в вакуум его температура не изменяется),
· для реального газа оно означает, что 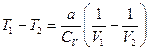 и поскольку V 2 > V 1, то T 1 > T 2 - т.е. реальный газ при адиабатическом расширении в вакуум охлаждается.
и поскольку V 2 > V 1, то T 1 > T 2 - т.е. реальный газ при адиабатическом расширении в вакуум охлаждается.
Изменение температуры реального газа в результате его адиабатического расширения (адиабатического дросселирования - медленного прохождения газа под действием перепада давления сквозь дроссель - пористую перегородку) называется эффектом Джоуля-Томсона.
Это явление используется для сжижения газа.
[Для самостоятельной работы]
Кипение и конденсация
Испарение
Испарение - это процесс превращения жидкости в пар.
Процесс испарения происходит со свободной поверхности жидкости. При испарении жидкость покидают более быстрые молекулы, поэтому средняя кинетическая энергия молекул жидкости уменьшается (температура жидкости понижается). Чем выше температура жидкости, тем большее число молекул имеет достаточную для вылета из жидкости кинетическую энергию, тем быстрее идёт испарение.
Вылетевшая молекула принимает участие в беспорядочном тепловом движении газа и она может не только навсегда удалиться от поверхности жидкости, находящейся в открытом сосуде, но может и вернуться снова в жидкость.
Динамическое равновесие — это состояние, при котором число молекул, покидающих жидкости за некоторый промежуток времени, равно числу молекул пара, возвратившихся в жидкость.
Конденсация
Конденсация – это процесс превращения пара в жидкость ( идеальный газ нельзя превратить в жидкость).
Ненасыщенный пар – это пар, который при сжатии постоянной температуре не превращается в жидкость(он описывается газовыми законами для систем с фиксированной массой и уравнением М-К pV=μRT).
Насыщенный пар – это пар, находящийся в динамическом равновесии со своей жидкостью. Такое равновесие устанавливается в закрытом сосуде при постоянной температуре.
Давление насыщенного пара рн п – это давление пара, при котором жидкость находится в равновесии со своим паром.
При постепенном сжатии насыщенного пара всё большая часть его переходит в жидкое состояние и в результате объём V насыщенного пара при неизменной его плотности (ρ = m/V) уменьшается. Следовательно, концентрация молекул насыщенного пара n = m/V и давление насыщенного пара рн.п. = nkT не зависят от занимаемого газом объёма. Важный факт: газовые законы для насыщенного пара несправедливы.
Состояние насыщенного пара описывается уравнением М-К pV=μRT, а его давление определяется формулой рн.п. = nkТ, т.е. казалось бы с ростом температуры давление должно линейно расти. Однако это не так: при нагревании жидкости в закрытом сосуде часть жидкости превращается в пар, в результате давление насыщенного пара растёт не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул n (плотности ρ) пара, причем в основном увеличение давления при повышении температуры определяется именно увеличением n.
Главное различие в поведении идеального газа (ненасыщенного пара) и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объёма при постоянной температуре) изменяется масса насыщенного пара.
Переход ненасыщенного пара в насыщенный.
При уменьшении объёма давление ненасыщенного пара увеличивается (участок 1  2) по законам идеального газа.
2) по законам идеального газа.

При определённом объёме пар становится насыщенным: происходит превращение части пара в жидкость (участок 2  3), над жидкостью будет находиться насыщенный пар.
3), над жидкостью будет находиться насыщенный пар.
Как только весь пар превратится в жидкость, дальнейшее уменьшение объёма вызовет резкое увеличение давления (жидкость мало сжимается).
Точка росы – это температура, при которой водяной пар становится насыщенным.
Критическая температура Ткр – это максимальная температура, при которой пар ещё может превратиться в жидкость (если температура пара выше Ткр, то при любом давлении пар не превратится в жидкость).
Газ – это состояние вещества при T > Ткр. Пар – это состояние вещества при Т < Tкр.
Кипение.
Кипение − это процесс парообразования, происходящий по всему объёму жидкости при температуре кипения; по всему объёму жидкости образуются пузырьки пара, которые всплывают на поверхность.
Температура кипения жидкости остаётся постоянной поскольку вся подводимая к жидкости энергия расходуется на превращение её в пар.
Испарение жидкости происходит и при температурах, меньших температуры кипения, но только с поверхности жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается и становится чуть больше давления в жидкости. Чем больше внешнее давление, тем выше температура кипения.
При откачиваии насосом воздуха и паров воды из колбы вода может кипеть при комнатной температуре. Для воды Ткр = 374оС и при 100оС рн.п = 101 325 Па (т.е. 760 мм рт. ст.).
Абсолютная влажность — это количество килограммов водяного пара, содержащееся в 1 м3 воздуха при данных условиях, т. е. это плотность водяного пара ρ (кг/м3).
Относительная влажность воздуха φ - это отношение абсолютной влажности воздуха ρ к плотности ρo насыщенного пара при той же температуре  или
или 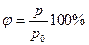 , где р0 – давление насыщенного пара, р – парциальное давление пара.
, где р0 – давление насыщенного пара, р – парциальное давление пара.