Газовая смесь – это механическая смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Газовая смесь может быть задана массовыми, объёмными и мольными долями:
 (3.1)
(3.1)
 (3.2)
(3.2)
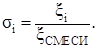 (3.3)
(3.3)
Причём, имеют место быть условия:
 (3.4)
(3.4)
Где k – количество газов, составляющих газовую смесь.
Соотношения, связывающие вышеприведённые уравнения:
 (3.5)
(3.5)
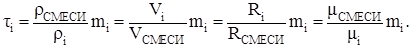 (3.6)
(3.6)
Газовая постоянная смеси газов:
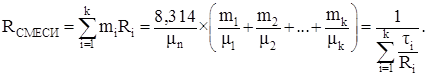 (3.7)
(3.7)
Средняя молекулярная масса смеси газов:
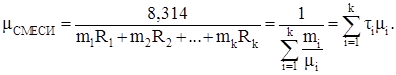 (3.8)
(3.8)
Парциальное давление газа:
 (3.9)
(3.9)
Задачи для самостоятельного решения.
Задача № 3-1. В резервуаре ёмкостью 125 м3 находится коксовый газ, при давлении P = 5 бар и температуре Т = 291 К. Газ имеет следующий объемный состав: τ(H2O) = 0,46, τ(CH4) = 0,32, τ(CO) = 0,15 и τ(N2) = 0,07. После отбора части газа его давление понизилось до 3 бар, а температура до 285 К. Определить массу израсходованного газа.
Задача № 3-2. Газовая постоянная смеси водорода Н2 и азота N2 равна RСМЕСИ = 882,54 Дж/(кг×К). Определить массовые доли водорода m(Н2) и азота m(N2), если давление смеси РСМЕСИ = 1,08 бар.
Задача № 3-3. Поток воздуха, имеющий часовой расход GВ = 300 кг/ч и температуру ТВ = 573 К, смешивается с потоком дымовых газов GГ = 400 кг/ч, ТГ = 873 К. Определить температуру смеси и объемные доли газов, если известно, что RГ = 289,277 Дж/(кг×К). Принять давление газов и воздуха одинаковыми, а теплоемкость газов равной теплоемкости воздуха.
Пример. Воздух имеет примерно следующий массовый состав m(O2) = 23,2% и m(N2) = 76,8%. Определить объемный состав воздуха, кажущуюся молекулярную массу, парциальное давление кислорода и азота, если давление воздуха по барометру РБ = 760 ммHg.
Решение.
Объёмный состав воздуха:

τ(N2) = 1 – τ(O2) = 1 – 0,21 = 0,79.
Кажущаяся молярная масса:

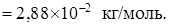
Газовая постоянная смеси:
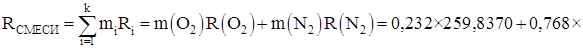

Парциальные давления газов:
P(O2) = τ(O2) × PБ = 0,21 × 760 = 159,6 ммHg.
P(N2) = PБ – P(O2) = 760 – 159,6 = 600,4 ммHg.
Задача № 3-4. Три газовых потока смешиваются между собой (см. рис.3.1). Первый поток представляет собой поток кислорода с расходом G = 115 кг/ч и температурой Т = 573 К, второй – поток оксида углерода с расходом G = 200 кг/ч и Т = 473 К. По третьему каналу течет воздух с температурой ТВ = 673 К.

Рис.3.1.
В результате смешивания этих потоков образуется смесь с температурой ТСМ = 548 К. Определить часовой расход воздуха, если известно, что давление всех трех газов одинаково.
Задача № 3-5. Смесь, состоящая из одного киломоль кислорода и двух киломоль азота при температуре Т1 = 303 К и давлении Р1 = 1 бар, охлаждается при постоянном объеме до температуры Т2 = 283 К. Определить изменение внутренней энергии смеси.
Задача № 3-6.0,3 м3 воздуха смешиваются с 0,5 кг углекислого газа. Оба газа до смешивания имели параметры Р = 6 бар и Т = 318 К. Определить парциальное давление углекислого газа после смешивания.
Задача № 3-7. Объемный состав горючего газа следующий: τ(CO) = 10%, τ(N2) = 45%, τ(CH4) = 35%, τ(C2H4) = 4%, τ(H2) = 3% и τ(CO2) = 3%. Определить кажущуюся молекулярную массу, плотность, удельный объем при нормальных условиях, газовую постоянную R и парциальное давление метана в процентах, а также массовую долю каждого компонента.
Задача № 3-8. Смесь газов состоит из 10 кг азота, 13 кг аргона и 27 кг диоксида углерода. Определить мольный состав смеси ее удельный объем при нормальных условиях, кажущуюся молекулярную массу смеси и газовую постоянную, отнесенную к одному нормальному кубическому метру.
Задача № 3-9. Дымовые газы имеют массовый состав: m(CO2) = 16,1%, m(O2) = 7,5% и m(N2) = 76,4%. Рассчитать энтальпию hСМЕСИ этих газов, отнесенную к одному килограмму смеси, при температуре 1073 К, отсчитанную от 273 К.