Изучение свойств буферных растворов
Цель работы: изучить свойства ацетатного и аммиачного буферных растворов.
Оборудование и реактивы:
1. pH-метр;
2. Стаканы, 50мл;
3. Пипетка, 10мл;
4. Уксусная кислота CH3COOH, 0,1М раствор;
5. Ацетат натрия CH3COONa, 0,1М раствор;
6. Аммиак NH3, 0,1 М раствор;
7. Хлорид аммония NH4Cl, 0,1 М раствор;
8. Соляная кислота HCl, 0,1н. раствор;
9. Гидроксид натрия NaOH, 0,1н. раствор.
Ход работы:
1. Приготовить ацетатный буферный раствор, для чего поместить в 2 стаканчика по 10 мл 0,1М растворов уксусной кислоты и ацетата натрия.
2. Приготовить аммиачный буферный раствор, смешав в 2 других стаканчиках по 10 мл 0,1М растворов аммиака и хлорида аммония.
3. Измерить значения рН буферных растворов и дистиллированной воды. Полученные данные занести в таблицу.
4. В три стаканчика (1-ый с дистиллированной водой, 2-ой с ацетатным буферным раствором, 3-ий с аммиачным буферным раствором) добавить по одной капле 0,1Н раствора HCl. Перемешать, измерить рН. результаты измерений занести в таблицу.
5. Повторить опыты по п.4, добавляя 0,1Н раствор NaOH.
6. Рассчитать рН полученных буферных растворов, результаты занести в таблицу.
Таблица. Значение рН буферных растворов
| ацетатная смесь | аммиачная смесь | вода | значение рН |
| исходный раствор | |||
| после добавления HCl | |||
| после добавления NaOH | |||
| расчетные значения рН исходных растворов |
7. Сделать выводы и составить отчет по работе.
Лабораторная работа № 7.
Свойства коллоидных растворов
Цель работы: получить золь берлинской лазури и изучить влияние электролитов на его коагуляцию.
Реактивы и оборудование:
1. K4[Fe(CN)6], 20%;
2. H2C2O4, 2%;
3. FeCl3 насыщ. р-р.;
4. KCl, 1 М;
5. BaCl2, 0,03М;
6. AlCl3, 0,005 М;
7. Колбы конические 250 мл.;
8. Воронки;
9. Пробирки;
10. Пипетки на 1, 2 и 5 мл.;
11. Фильтры.
Ход работы:
1. 1,5 мл 20% раствора желтой кровяной соли K4[Fe(CN)6] разбавляют водой до 100 мл, добавляют 0,5 мл насыщенного раствора хлорного железа.
2. Выпавший осадок переносят на фильтр, промывают водой, заливают на фильтре 2-3 мл 2% раствора щавелевой кислоты, осторожно размешивают стеклянной палочкой. Осадок быстро пептизируется, через фильтр проходит синий золь берлинской лазури, стабилизированный ионом оксалата. Полученный золь разбавляем водой до 100 мл.
3. Для определения порога коагуляции готовят растворы электролитов с убывающей концентрацией (см. табл. 1). В каждую из пробирок добавляют по 5 мл золя. Содержимое пробирок перемешивают, записывают время начала опыта и оставляют на 3 мин. для прохождения явной коагуляции.
4. Готовят контрольный раствор, сливая 5 мл исходного золя с 5 мл дистиллированной воды. Коагуляцию после сравнения контрольного и исследуемого растворов отмечают знаком (+) в табл. 1, отсутствие коагуляции – знаком (-).
5. Расчет порога коагуляции проводится по формуле:
γ = 100 ∙ С∙V
Где γ – порог коагуляции;
С – молярная концентрация раствора электролита;
V – минимальное число мл этого электролита, достаточное для коагуляции 10 мл золя.
Коэффициент 100 введен для пересчета на 1 л раствора.
Таблица для оформления отчета:
| № | коагулятор | Порог коагуляции | Номер пробирки | ||||||
| Эл-т | ион | ||||||||
| KCl | |||||||||
| BaCl2 | |||||||||
| AlCl3 | |||||||||
| V, мл | Дист. воды | 0,5 | 1,5 | 2,25 | |||||
| р-ра эл-та | 2,5 | 1,5 | 0,5 | 0,25 | |||||
| золя | 2,5 | 2,5 | 2,5 | 2,5 | 2,5 | 2,5 |
6. Сделать выводы и составить отчет по работе.
Лабораторная работа №8.
Распределение йода между органическим растворителем и водой
Цель работы: определить коэффициент распределения йода между четыреххлористым углеродом и водой.
Оборудование и реактивы:
1. Делительная воронка (100мл);
2. Конические колбы емкостью 50мл;
3. Пипетки 5, 10 и 25 мл;
4. Стаканы емкостью 50 мл;
5. Мензурка или мерный цилиндр;
6. Весы;
7. Бюретка.
8. Йод кристаллический;
9. Дистиллированная вода;
10. Раствор тиосульфата натрия 0,05н.;
11. Раствор крахмала 1%;
12. Четыреххлористый углерод.
Схема реакции:
Реакция протекает по уравнению:
Na2S203 + I2 = NaI + Na2S4O6
(бесцветн.) (окраш.) (бесцветн.) (бесцветн.)
Ход работы:
1. Отмерить 50 мл дистиллированной воды и 25 мл амилового спирта и вылить их в цилиндр с притертой пробкой.
2. Взвесить 0,5 г йода (на технохимических весах); высыпать его в делительную воронку, закрыть пробкой и энергично перемешивать смесь растворов, встряхивая делительную воронку (придерживая пробку) в течение 5 мин. Оставить делительную воронку в покое на несколько минут, пока не произойдет полное расслаивание водного и спиртового растворов.
3. В это время налить в бюретку титрованный 0,05 н. раствор тиосульфата натрия Na2S203 на 3- 4 см выше нулевого деления. Поместив под бюретку пустой стакан, тщательно заполнить раствором носик бюретки, чтобы в нем не оставалось пузырьков воздуха и установить уровень раствора в бюретке на нулевом делении.
4. После того, как в делительной воронке произойдет полное расслоение жидкостей, отобрать в стакан спиртовой раствор из делительной воронки.
5. Отобрать в конические колбочки сухой пипеткой 5 мл спиртового раствора йода и добавить к нему 5 мл дистиллированной воды. Взбалтывая содержимое конической колбочки, добавлять в нее из бюретки по 3-4 капли раствора тиосульфата до тех пор, пока окраска спиртового раствора из интенсивной перейдет в бледно-розовую. После этого прилить в колбочку 1 мл раствора крахмала, вследствие чего раствор посинеет, и продолжать титрование до полного обесцвечивания раствора.
6. Записать в журнал объем раствора тиосульфата, пошедший на титрование первой пробы спиртового раствора йода.
7.В другой стакан слить водный раствор. В коническую колбу отобрать сухой пипеткой 15 мл водного раствора йода. Прилить в колбочку 1 мл раствора крахмала, что снова вызовет посинение раствора, и осторожно титровать тиосульфатом натрия - до исчезновения синей окраски. Записать в журнал объем раствора тиосульфата, пошедший на титрование первой пробы водного раствора йода.
8.Провести расчет коэффициента распределения йода между амиловым спиртом и водой, записав экспериментальные данные и результаты расчетов в таблицу по приведенной ниже форме.
Коэффициент распределения Кравен отношению концентраций растворенного вещества в первом ивтором растворителях:
K= 
где c1 и с2 обычно выражают в г/л.
Рассчитать нормальность йода  в каждой пробе по уравнению:
в каждой пробе по уравнению:

Выразить концентрацию йода с2в каждой пробе в г/л, для чего умножить нормальность растворов йода на моль экв. йода, равную 126,9г. Вычислить коэффициент распределения

по первой и второй пробам.
8. Сделать выводы по работе и составить отчет.
Таблица для оформления отчета:
| Наименование Раствора | № пробы | Vр-ра йода (пипетка) мл | V р-ра Na2S2O3, пошедший на титрование, мл | Нормальность растворов йода | Сйода в пробах, г/л |
| Спиртовой | |||||
| Водный | |||||
Лабораторная работа №9.
Определение жесткости воды
Цель работы: определить общую, карбонатную, некарбонатную и остаточную жесткость водопроводной воды.
Оборудование и реактивы:
1. Раствор ЭДТА (комплексона III, трилона Б), 0,05М;
2. Аммиачный буферный раствор;
3. Соляная кислота, 0,1н.;
4. Эриохром черный Т, сух.;
5. Метиловый оранжевый, 0,5% р-р.;
6. Бюретка, 25 мл.;
7. Колбы конические, 250 мл;
8. Пипетки, 5, 100мл;
9.Мерные колбы, 50 мл.
Ход работы:
1. Определение общей жесткости воды.
В коническую колбу на 250 мл пипеткой отбирают 100 мл водопроводной воды, затем добавляют 5 мл аммиачного буферного раствора, насыпают на кончике шпателя индикатор эриохром черный Т. Пробу титруют при интенсивном перемешивании 0,05М раствором ЭДТА до изменения окраски из розовой в голубую.
Общую жесткость воды Х в мг-экв/л определяют по формуле:

Где v – объем ЭДТА в мл пошедший на титрование;
V – объем воды, взятый для определения, мл.
2. Определение карбонатной жесткости воды.
В коническую колбу отбирают 100 мл исследуемой воды, добавляют 2-3 капли метилового оранжевого и титруют 0,1н раствором соляной кислоты до перехода желтой окраски в устойчивую оранжевую.
Карбонатную жесткость Х1 в мг-экв/л рассчитывают по формуле:

Где, v – объем HCl, израсходованный на титрование пробы, мл;
V – объем воды, взятый для определения, мл.
3. Определение остаточной жесткости воды.
Приготовление раствора 0,01н HCl: в мерную колбу на 50 мл пипеткой отбираю 5 мл 0,1н HCl, доводят до метки.
В коническую колбу отбирают 100 мл дистиллированной воды, добавляют 2-3 капли метилового оранжевого и титруют приготовленным 0,01н раствором соляной кислоты.
Остаточную жесткость Х2 мг-экв/л рассчитывают по формуле:

Где, v – объем 0,01н HCl, пошедший на титрование пробы, мл;
V – объем воды, взятый для определения, мл.
4. По разнице карбонатной и остаточной жесткости определяют устранимую жесткость Х3 мг-экв/л. По разнице общей и карбонатной жесткости определяют некарбонатную жесткость Х4 мг-экв/л.
5. Все результаты представляют в виде Х=(Хср ± ΔХ) мг-экв/л. Оформляют выводы по работе.
Статистическая обработка результатов.
Среднее значение вычисляют по формуле:

Затем рассчитывают стандартное отклонение от среднего:

Для удобства расчетов S можно для каждой группы расчетов построить таблицу:
| № опыта | Хi | Xi - Xср | (Xi - Xср)2 |
| … | |||
| ∑ | - |
Рассчитав S можно посчитать ΔХ – доверительный интервал:
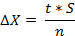
Значения t – коэффициент Стьюдента приведены в таблице:
| n | Уровень доверительной вероятности | ||
| 0,90 | 0,95 | 0,99 | |
| 6,31 | 12,7 | 63,6 | |
| 2,92 | 4,30 | 9,93 | |
| 2,35 | 3,18 | 5,34 | |
| 2,13 | 2,78 | 4,60 | |
| 2,02 | 2,57 | 4,03 | |
| 1,94 | 2,45 | 3,71 | |
| 1,86 | 2,37 | 3,50 | |
| 1,83 | 2,31 | 3,35 | |
| 1,83 | 2,26 | 3,25 |
Рекомендуемая литература
1. Глинка. Николай Леонидович. Общая химия / Н. Л. Глинка. - М.: Юрайт. 2010.
2. Практикум по общей и неорганической химии / [В. В. Батраков [и др.]. – М.: КолосС. 2007.
Ю.И. Сухарев, И.Ю. Апаликова, Н.В. Пыхова, И.Ю.Лебедева. Химия коллоидных систем; Учеб. пособие по лабораторным работам - Челябинск: Изд-во ЧелГУ, 2008. - 45 с.
4. Иванов, В. Г. Органическая химия: учеб. пособие / В. Г. Иванов, В. А. Горленко, О. Н. Гева. М.: Академия, 2009. 624 с.
Содержание
Основные правила при работе в химической лаборатории 3
Требования к технике безопасности при работе
химической лаборатории 4
Оформление лабораторного журнала 5
Лабораторная работа № 1. Изучение химической посуды 5
Лабораторная работа № 2. Определение плотности
растворов 11
Лабораторная работа № 3. Очистка сульфата меди 12
Лабораторная работа № 4. Кинетика химической реакции 13
Лабораторная работа № 5. Получение хромокалиевых
квасцов 15
Лабораторная работа № 6. Изучение свойств буферных растворов 17
Лабораторная работа № 7. Свойства коллоидных
растворов 18
Лабораторная работа № 8. Распределение йода между органическим растворителем и водой 20
Лабораторная работа № 9. Определение жесткости воды 23
Рекомендуемая литература 26
Содержание 27