(4) pH=14-pOH pOH=-lgC[OH-] pOH=3.34 pH=10.66
Билет
Метод МО. Энергетические диаграммы гомоядерных молекул. Энергетически диаграммы для частиц: O2, C2, N2 (порядок, энергия, длина связи).
Необратимый гидролиз. Совместный гидролиз.
Цинк, кадмий. Химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль цинка.
(1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу.
В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов.
Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями.
N2. Электроны 1s слоя участие в образовании химической связи не принимают, 8 орбиталей внешнего слоя 2х атомов азота комбинируются в 8 МО. На 2s и 2p орбиталях находится 10е. При образовании молекулы е заселяют орбитали с наиболее низкой энергией. Разрыхляющие орбитали П*2рх, П*2ру и 6*2рz остаются незаселенными, е 2s орбиталей, заполняя при комбинировании связывающую и разрыхляющую орбитали, фактически не образуют хим. Связи – это неподелынные электронные пары на атомах азота. Порядок связи в молекуле азота 3, энергия связи 940 кДж/ моль.
О2. Отличительная особенность - орбитали П*2рх, П*2ру и 6*2рz находится. Во внешнем слое 12 е, 10е заполняют 62s, 6*2s, 62pz, П2px, П2py. 2е должны быть на П*2px – П*2py.
Так как энергии равны, то по правилу Хунда е занимают обе орбитали, порядок связи 2. В молекуле 2 неспаренных е – она парамагнитна. Е связи 494 кДж /моль. 
(2)Гидролиз-обменное взаимодействие между ионами соли и водой
Особые случаи гидролиза. Необратимый гидролиз. Необратимый гидролиз известен только для некоторых солей — Cr2S3, A12S3 и др. В воде эти соли полностью разлагаются:
Cr,S3 + 6Н0Н -> 2Сг(0Н)3 + 3H2S.
К числу особых случаев гидролиза следует отнести и совместный гидролиз. Совместный гидролиз возможен в растворе двух или более солей. Условием для протекания этого типа гидролиза является гидролиз одной соли по катиону, а второй — по аниону:
А” + НОН НА + ОН", Ме+ + НОН МеОН + Н\
Образующиеся гидроксид-ионы и ионы водорода выводятся из сферы реакции в виде молекулы воды.
Этот тип — тип необратимого гидролиза. Он характерен для солей металлов со степенями окисления +3 и +2 (Fe3+, Ст3+. Си2*, Zn2+ и др.). Природа продуктов гидролиза определяется природой их солей. В случае солей металлов со степенями окисления +3 продуктами реакции является слабые основания и кислота:
CrCl3 + 3Na2C03 + 6Н20 -> 2Сг(ОН)3 + Н2С03 + 6NaCI
2А1С13 + 3Na2S + 6 Н20 = 2А1(ОН)3 + 6NaCl + 3H2S.
Если соль образована металлами со степенями окисления +2, то один из продуктов реакции — основная соль:
2CuC12 + 2Na2C03 + Н20 = (Cu0H)2C03 + СО, + 2NaCl.
(3). Цинк и кадмий сгорают в токе кислорода с образованием оксидов ЭО.С серой и галогенами цинк и кадмий реагируют только при нагревании. В ряду Zn-Cd-Hg химическая активность понижается, что подтверждается и значениями стандартных электродных потенциалов (табл. 5). Цинк и кадмий не взаимодействуют с водой, так как покрыты защитной оксидной пленкой. В растворах аммиака защитная пленка растворяется: Zn + 4NH3 +2Н20 = [Zn(NH3)4](OH)2 + H2t Цинк вытесняет водород из кислот и щелочей, кадмий — только из кислот: Cd +2НС1 = CdCl2 + Н2Т Zn +2КОН + 2Н20 = K2[Zn(OH)4] + Н2Т. Цинк и кадмий восстанавливают концентрированную серную кислоту до S02, а при нагревании — до H2S: 4Zn + 5H2S04 = 4ZnS04 + H2St +4H20 Cd + 2H2S04 = CdS04 + S02T + 2H20 Цинк и кадмий ведут себя по отношению к HN03 значительно активнее. Цинк, например, способен максимально восстанавливать очень разбавленную HN03: 4Zn + 10HN03 = 4Zn(N03)2 + NH4N03 +3H20 Цинк, кадмий и ртуть легко образуют сплавы как друг с другом, так и с другими металлами.Гидроксиды цинка и кадмия получают обменной реакцией соответствующих солей со щелочами. Zn(OH)2, Cd(OH)2 — малорастворимые, бесцветные соединения. Гидроксид цинка амфотерен с преобладанием основных свойств:Zn(OH)2 + 2Н+ = Zn2+ + 2Н20 Zn(OH)2 + 20Н = [Zn(OH)4]2 С увеличением радиуса катиона от Zn к Cd усиливаются основные свойства. Cd(OH)2 проявляет кислотные свойства только при длительном кипячении с концентрированной щелочью. Оба гидроксида растворяются в аммиаке с образованием комплексов: Э(ОН)2 + 4NH3 = [3(NH3)4]2+ + 20Н Гидроксиды ртути не получены в свободном виде, так как разлагаются с отщеплением воды из-за сильного поляризующего действия катионов ртути на гидроксид- ионы: Hg(N03)2 + 2NaOH = HgO + 2Н20 + 2NaN03 Hg2(N03)2 + 2NaOH = Hg20 + H20 + 2NaN03 В присутствии растворимых карбонатов соли цинка и кадмия полностью гидролизованы с выделением осадков основных солей: 2Э2+ + 2С032 + Н20 = (Э0Н)2С03 + С02 Электрическая проводимость растворов однотипных солей цинка, кадмия и ртути в ряду Zn-Cd-Hg уменьшается. Электрическая проводимость растворов обусловлена концентрацией ионов в растворе. В воде соли цинка ионизированы практически полностью, соли кадмия образуют аутокомплексы типа Cd[CdX3]2 и Cd[CdX4], Поэтому в растворах солей кадмия концентрация ионов, а вместе с ней и электрическая проводимость, меньше, чем в растворах аналогичных солей цинка. При добавлении аммиака к растворам солей цинка и кадмия образуются аммиачные комплексы состава [3(NH3)4]2+ или [3(NH3)2Cl2]. [Zn(NH3)2Cl2] — молекулярное соединение, имеющее тетраэдрическое строение; [Cd(NH3)2Cl2] — полимер с координационным числом кадмия 6.Цинк необходим животным для нормального роста, дыхания и кровеобразования.
(4) C(H+)=sqrt(Ka*Cm) C(H+)=10-5 моль/л pH=-lg[H+] =5
Билет
Метод молекулярных орбиталей (ММО). Порядок заполнения молекулярных орбиталей. Условия устойчивости молекул. Кратность связей в ММО.
Гидролиз солей. Степень и константа гидролиза. Факторы, влияющие на степень гидролиза солей.
Общая характеристика s-элементов I группы. Характер связи в соединениях. Химическая активность.
(1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу.
В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями. Принципы заполнения АО:
Принцип наименьшей энергии Правило Хунда(суммарное значение спинового квантового числа данного подслоя должно быть максимальным) Правило Паули(2 и более тождественные частицы не могут находиться в одном квантовом состоянии) Порядок заполнения должен быть таким, чтобы при данном числе электронов обеспечивалась минимальная энергия молекулярной системы. Первой заполняется орбиталь с наименьшей энергией. Орбитали располагаются в соответствии с порядком возрастания их энергии:
61s<61s*<62s<62s*<62pz<П2p= П2p< П*2p=< П*2p<62pz* Размещение электронов на связывающих орбиталях стабилизирует молекулу, заполнение разрыхляющих орбиталей, наоборот, разрыхляет, делает менее прочными связи в молекуле. Условия устойчивости молекул: молекула будет устойчива только тогда, когда сумма электронов на связывающих орбиталях превышают сумму электронов на разрыхляющих орбиталях 
Pim = (neсв-ne*)/2
Pim > 0 молекула существует
(2) Гидролиз — обменное взаимодействие между ионами соли и водой.
В реакцию гидролиза вступают:
соли, образованные слабой кислотой и сильными основаниями (KN02, Na,P04, NaX03 и т. д.);
соли, образованные слабым основанием и сильной кислотой (NH4C1, CuCl2, ZnClj FeClj и т.д.);
соли, образованные и слабым основанием и слабой кислотой (NH4CN, (NH4)2S и т. д.).
1) Степень гидролиза.
2) Kг (Кр) – константа гидролиза, выводимая на основании закона действующих масс применительно ионного уравн 

Природа вещества.
Концентрация соли: степень гидролиза увеличивается с уменьшением концентрации соли, что связано с увеличением концентрации воды.Повышение температуры усиливает гидролиз, т.е. это процесс эндотремический.
Добавление кислот и оснований:

(3)Все s-элементы I группы проявляют устойчивую степень окисления +1.
Т.к. значения энергии ионизации низкие, проявляются сильные восстановительные свойства атомов. С увеличением порядкового номера усиливаются металлические свойства. В свободном состоянии s-элементы I и II группы-металлы серебристо-белого цвета. Щелочные металлы имеют рыхлую кристаллическую решетку, легкие, низкоплавкие, s-элементы химически активны. s-элементы I группы образуют с кислородом оксиды Э2О, пероксиды Э2О2, надпероксиды ЭО2(Э2О4) и озониды ЭО3. С ростом радиуса атомов при переходе от лития к цезию устойчивость пероксидов увеличивается, а оксидов – уменьшается. При взаимодействии с кислородом литий образует оксид: 4Li+O2 =2LiO2 натрий – пероксид:2Na+ O2 = Na2O2 элементы подгруппы калия – надпероксиды: K+ O2 =KO2 Озониды образуют только калий, рубидий, цезий:
K+ O3 =KO3 4KOH+4O2 = KO3 + O2 +2H2O Оксиды натрия и элементов подгруппы калия получают из пероксидов: Na2O2 + 2Na=2Na2O. Биологическая роль: тело животных и человека состоит частично из этих атомов, которые осуществляют многие процессы в организме.
(4) Ksp=S2 S=1.14*10-4моль/л V=m/(c*M)=2.895л
Билет
Метод ВС. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекул.
Энергия Гиббса как критерий самопроизвольного протекания процесса.
Кобальт, никель. Строение атома, степени окисления, химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль кобальта.
(1)
С помощью метода валентных связей можно определить геометрическую форму молекулы, зная, какие из гибридных орбиталей заполняются электронами.

sp – линейная,
sp2 – треугольная,
sp3 – идеальный тетраэдр,
sp2d – квадрат, согласно теории гибридизации
dsp3 – тригональная бипирамида,
sp3d2 – октаэдр,
d2sp3 – октаэдрическая форма
(2)Из-за того, что тепловой эффект реакции(ΔH) не может являться критерием самопроизвольности процесса(из-за того, что существуют самопроизвольные экзогенные процессы и эндотермические реакции), вводится изобарно-изотермический потенциал –ΔG - энергия Гиббса. Основной критерий – переходит ли система в более устойчивое состояние. Энергия Гиббса зависит от:
энтальпийного фактора: стремление частиц образовывать сложные связи для понижения П(потенциальной энергии)
энтропийного фактора: при повышении температуры частицы стремятся разорвать связи
Таким образом, энергия Гиббса наиболее четко показывает устойчивость системы:ΔG=ΔH-TΔS
ΔG<0 – процесс протекает самопроизвольно
ΔG=0 – процесс равновесный
ΔG>0 – процесс не протекает самопроизвольно
(3) Кобальт и никель устойчивы к воздействию воды, так как защищены оксидной пленкой. Кобальт и никель взаимодействуют с серой и галогенами только при нагревании. В очень мелкораздробленном состоянии кобальт и никель обладают пирофорными свойствами, то есть воспламеняются на воздухе при обычной температуре.Кобальт и никель вытесняют водород из разбавленных кислот: Э + НС1 = ЭС12 + н2, но не реагируют с растворами щелочей. В обычных условиях концентрированные серная и азотная кислоты пассивируют эти металлы, а при нагревании окисляют до солей кобальта(П), никеля(П): Со + 2H2S04 = C0SO4 + S02 + 2Н20 конц. В ряду Fe(OH)2, Со(ОН)2, Ni(ОН)2 увеличивается устойчивость гидроксидов и уменьшаются восстановительные свойства. Гидроксид железа(П) окисляется кислородом воздуха в момент получения, Со(ОН)2 — значительно медленнее, а №(ОН)2 на воздухе устойчив и окисляется под действием более сильных окислителей: 2Ni(OH)2 + NaCIO + Н20 = 2Ni(OH)3 + NaCl В ряду Fe(OH)3, Со(ОН)з, Ni(ОН)з устойчивость гидроксидов уменьшается, окислительные свойства возрастают. Гидроксиды кобальта(Ш) и никеля(Ш) окисляют концентрированные НС1 и H2S04: 2Ni(OH)3 + 6НС1 = 2№С12 + С12 + 6Н20 4Ni(OH)3 + 4H2S04 = 4NiS04 + 02 + 10Н20 Кобальт(П) и никель(П) чрезвычайно склонны к образованию комплексных соединений с координационными числами 4 и 6: Ni(CO)4, K2[Ni(CN)4], Н2[СоС14], [Со(Н20)6]С12, [Ni(NH3)6]Cl2, и другие. Кобальт(Ш) образует прочные связи с лигандами, содержащими донорный атом азота (аммиак, этилендиамин, тиоцианат-ион и другие). Так, ион гексааминкобальт(П) легко окисляется в растворе кислородом воздуха в более устойчивый ион гексааминкобальт(Ш): 4[Co(NH3)6]C12 + 2Н20 + 02 = 4[Co(NH3)6](OH)C12 Для качественного и количественного определения никеля(П) применяется реакция с реактивом Чугаева (этанольный раствор диметилглиоксима), в результате которой образуется диметилглиоксимат никеля — осадок малинового цвета.
(4) C =m/ M*V=0,033 моль/л pKa=-lgKa=4.7447 pH=(4.7447-lg0.033)/2=3.1131
Билет
Квантово-механическая модель строения атома. Основные принципы, определяющие порядок заполнения электронных орбиталей.
Обратимые и необратимые химические реакции и состояние химического равновесия. Константа равновесия в гомо- и гетерогенных системах. Принцип Ле-Шателье.
Сопоставление свойств простых веществ и соединений элементов главной и побочной подгруппы VII группы. Оксиды, гидроксиды VIIА и VIIВ групп.
(1) Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства. В котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Собственной характеристикой каждого электрона в атоме является спин. Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
В квантовой механике каждая атомная орбиталь определяется тремя квантовыми числами.
Главное квантовое число n – может принимать целочисленные значения от 1 до ¥. В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l – определяем орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбитали. Может принимать значения 0,1,2,3,…(n-1). Орбитальное квантовое число определяет форму атомной орбитали. При l=0 это сфера, при l=1 – объемная восьмерка (гантель), при l =2 четырехлепестковая розетка.
Магнитное квантовое число ml определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например ось Z) движение электрона вокруг ядра можно сравнить с движением тока по замкнутому контуру. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления. Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа ml =0. Эти значения l и ml характеризуют все s –орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s подуровень состоит только из одной орбитали. Рассмотрим р-подуровень. При l =1 орбитали имеют форму гантелей, магнитное квантовое число принимает следующие значения ml = -1, 0, +1. Следовательно, р-подуровень состоит из трех атомных орбиталей, которые располагаются вдоль осей координат, их обозначают рx, рy, рz (2) Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия. Направление смещения равновесия определяется принципом Ле Шателье: Любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения. 1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса. 2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа моль газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смешается в сторону увеличения числа моль газообразных веществ, т.е. в сторону увеличения давления. 3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию и наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, химическое равновесие является динамическим равновесием. Отношение констант скоростей прямой и обратной реакций является также величиной постоянной и носит название константы химического равновесия. Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия. Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом: 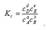 Константа равновесия гетерогенных реакций не включает концентрации твердых веществ. Химические реакции-это явления, при которых одно (или одни) вещества превращаются в другие, доказательством этого являются видимые и невидимые изменения. Видимые: изменени цвета, запаха, вкуса, выпадение осадка, изменение окраски индикатора, поглощение и выделение тепла. Невидимые: изменение состава вещества, которое можно определить с помощью качественных и аналитческих реакций. Все эти реакции можно подразделить на два типа: обратимые и необратимые реакции. Необратимые реакции. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании: 2KClO 3 = 2KCl + 3O2 Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа.образуется малодиссоциированное соединение, например вода. реакция сопровождается большим выделением энергии, например горение магния Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль.Реакцию называют обратимой, если её направление зависит от концентраций веществ - участников реакции. Например, в случае гетерогенно-каталитической реакции N2 + 3H2 = 2NH3 (1) при малой концентрации аммиака в газовой си и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. (3)Мn — 3 d54s2 Тс — 4d55s2 Re — 4f145s2p6d5 6 s Валентными электронами в атомах d-элементов группы VII являются (п - 1)d5ns2. Близкие значения атомных и ионных радиусов технеция и рения («лантаноидное сжатие») обуславливают сходство свойств этих элементов и отличие их от свойств соединений марганца. При переходе от марганца к рению уменьшается устойчивость низших степеней окисления и возрастает устойчивость высших степеней окисления, как и в ряду d- элементов группы VI. Так, для марганца наиболее устойчива степень окисления +IV, а для технеция и рения — +VII. Кислородом марганец окисляется до Мп02, а технеций и рений — до Э 2 07. Марганец способен вытеснять водород из кислот, а при нагревании — разлагать воду: Мп + 2Н20 = Мп(ОН )2 + Н2| Для технеция и рения образование катионных соединений не характерно, эти металлы малоактивны и с разбавленными кислотами не взаимодействуют. Концентрированная азотная кислота окисляет их до технециевой и рениевой кислот: Э + 7HN0 3 = НЭ0 4 + 7N02| + 3H20. В этих же условиях марганец реагирует как металл, образуя соль марганца(П): Мп + 4HN0 3 = Mn(N0 3)2 + 2N02| + 2Н20. В степени окисления +II марганец образует оксид МпО, гидроксид Мп(ОН )2 . Оксид и гидроксид марганца(П) проявляют слабые основные свойства и растворяются только в сильных кислотах с образованием солей катионного типа. ). В степени окисления III марганец образует неустойчивые оксид Мп 2 03, слабое основание Мп(ОН )3. ). Оксид марганца(4) Мп0 2 проявляет окислительно-восстановительную двойственность. В кислой среде он восстанавливается до соединений марганца(2): Мп0 2 + 4НС1 = МпС1 2 + С12| + 2Н20. При сплавлении с окислителями в присутствии щелочи оксид марганца(4) проявляет свойства восстановителя: 3Mn0 2 + 6 КОН + КС10 3 = 3K 2 Mn0 4 + ЗН20 + КС1 В нейтральной среде он устойчив. Мп0 2 легко образуется из других соединений марганца в нейтральной, а также слабокислой и слабощелочной средах. В обменных реакциях диоксид марганца проявляет амфотерные свойства, образуя неустойчивые соли. Марганцовая кислота в свободном виде не выведена(H2Mno4). Соединения маргаца(7) представлены марганцевой кислотой. Марганцовую кислоту можно получить, окисляя в сильнокислой среде соли марганца(П) висмутатом натрия 2MnS0 4 + 5NaBi0 3 + 16HN03 = 2HMn0 4 + 5Bi(N0 3)3 + NaN0 3 + 2Na 2 S0 4 + 7H20. Соединения марганца(7) неустойчивы. Кислотно-основные свойства гидроксидов зависят от степени окисления марганца. С возрастанием степени окисления увеличивается ковалентность связи Мп-О, поэтому усиливается ионизация гидроксидов по кислотному типу и уменьшается по основному. Так, Мп(ОН )2 — слабое основание, Мп(ОН )4 — амфолит, НМп0 4 — сильная кислота. В ряду Мп(ОН)2, Мп(ОН)3, Мп(ОН)4, (Н 2 Мп04), НМп0 4 усиливаются кислотные свойства, а основные ослабевают.
Константа равновесия гетерогенных реакций не включает концентрации твердых веществ. Химические реакции-это явления, при которых одно (или одни) вещества превращаются в другие, доказательством этого являются видимые и невидимые изменения. Видимые: изменени цвета, запаха, вкуса, выпадение осадка, изменение окраски индикатора, поглощение и выделение тепла. Невидимые: изменение состава вещества, которое можно определить с помощью качественных и аналитческих реакций. Все эти реакции можно подразделить на два типа: обратимые и необратимые реакции. Необратимые реакции. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании: 2KClO 3 = 2KCl + 3O2 Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа.образуется малодиссоциированное соединение, например вода. реакция сопровождается большим выделением энергии, например горение магния Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль.Реакцию называют обратимой, если её направление зависит от концентраций веществ - участников реакции. Например, в случае гетерогенно-каталитической реакции N2 + 3H2 = 2NH3 (1) при малой концентрации аммиака в газовой си и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. (3)Мn — 3 d54s2 Тс — 4d55s2 Re — 4f145s2p6d5 6 s Валентными электронами в атомах d-элементов группы VII являются (п - 1)d5ns2. Близкие значения атомных и ионных радиусов технеция и рения («лантаноидное сжатие») обуславливают сходство свойств этих элементов и отличие их от свойств соединений марганца. При переходе от марганца к рению уменьшается устойчивость низших степеней окисления и возрастает устойчивость высших степеней окисления, как и в ряду d- элементов группы VI. Так, для марганца наиболее устойчива степень окисления +IV, а для технеция и рения — +VII. Кислородом марганец окисляется до Мп02, а технеций и рений — до Э 2 07. Марганец способен вытеснять водород из кислот, а при нагревании — разлагать воду: Мп + 2Н20 = Мп(ОН )2 + Н2| Для технеция и рения образование катионных соединений не характерно, эти металлы малоактивны и с разбавленными кислотами не взаимодействуют. Концентрированная азотная кислота окисляет их до технециевой и рениевой кислот: Э + 7HN0 3 = НЭ0 4 + 7N02| + 3H20. В этих же условиях марганец реагирует как металл, образуя соль марганца(П): Мп + 4HN0 3 = Mn(N0 3)2 + 2N02| + 2Н20. В степени окисления +II марганец образует оксид МпО, гидроксид Мп(ОН )2 . Оксид и гидроксид марганца(П) проявляют слабые основные свойства и растворяются только в сильных кислотах с образованием солей катионного типа. ). В степени окисления III марганец образует неустойчивые оксид Мп 2 03, слабое основание Мп(ОН )3. ). Оксид марганца(4) Мп0 2 проявляет окислительно-восстановительную двойственность. В кислой среде он восстанавливается до соединений марганца(2): Мп0 2 + 4НС1 = МпС1 2 + С12| + 2Н20. При сплавлении с окислителями в присутствии щелочи оксид марганца(4) проявляет свойства восстановителя: 3Mn0 2 + 6 КОН + КС10 3 = 3K 2 Mn0 4 + ЗН20 + КС1 В нейтральной среде он устойчив. Мп0 2 легко образуется из других соединений марганца в нейтральной, а также слабокислой и слабощелочной средах. В обменных реакциях диоксид марганца проявляет амфотерные свойства, образуя неустойчивые соли. Марганцовая кислота в свободном виде не выведена(H2Mno4). Соединения маргаца(7) представлены марганцевой кислотой. Марганцовую кислоту можно получить, окисляя в сильнокислой среде соли марганца(П) висмутатом натрия 2MnS0 4 + 5NaBi0 3 + 16HN03 = 2HMn0 4 + 5Bi(N0 3)3 + NaN0 3 + 2Na 2 S0 4 + 7H20. Соединения марганца(7) неустойчивы. Кислотно-основные свойства гидроксидов зависят от степени окисления марганца. С возрастанием степени окисления увеличивается ковалентность связи Мп-О, поэтому усиливается ионизация гидроксидов по кислотному типу и уменьшается по основному. Так, Мп(ОН )2 — слабое основание, Мп(ОН )4 — амфолит, НМп0 4 — сильная кислота. В ряду Мп(ОН)2, Мп(ОН)3, Мп(ОН)4, (Н 2 Мп04), НМп0 4 усиливаются кислотные свойства, а основные ослабевают.
F ls22s2p5 Cl 1s22s2p63s2p5 Br 3s2p6d104s2p5 I 4s2p6d105s2p5 С увеличением порядкового номера элемента радиусы атомов монотонно возрастают. Вследствие этого уменьшаются энергия ионизации, энергия сродства к электрону и относительная электроотрицательность (ОЭО), ослабляются окислительные и нарастают восстановительные свойства свободных галогенов. Аномальное значение энергии сродства к электрону у фтора объясняется более высокой электронной плотностью и значительно меньшим, чем у других галогенов, радиусом атома, а в связи с этим более сильным отталкиванием электрона. В ряду F, Cl, Br, I уменьшаются неметаллические свойства. Если фтор — типичный неметалл, то йод проявляет такие свойства металлов, как металический блеск в кристаллическом состоянии, способность к образованию солей катионного типа 1(СНзСОО)з], амфотерность НIO. Хлор, бром, йод в соединениях проявляют степени окисления от -I до VII, что обусловлено наличием d-подуровня в атомах. Степень окисления фтора, как самого электроотрицательного элемента, в соединениях с другими элементами всегда -I. Галогены образуют соединения с положительными степенями окисления с элементами, имеющими более высокие значения ОЭО. Хлор, бром и йод имеют положительные степени окисления в соединениях с кислородом (оксиды, кислородосодержащие кислоты и их соли), азотом (хлорамины и др.) и в межгалоидных соединениях. Фтор не образует соединений с положительными степенями окисления. фтор и хлор — газы, бром — жидкость, йод — кристаллическое вещество. Свободные галогены являются сильными окислителями. Непосредственно взаимодействуют с металлами и большинством неметаллов, кроме углерода, азота и кислорода. Фтор не проявляет восстановительных свойств. Восстановительные свойства хлора, брома и йода возрастают с увеличением порядкового номера элемента. Кислоты НГО — слабые элекгролиты, сила которых уменьшается в ряду НСlO, HBrO, НIO, вследствие увеличения радиусов атомов галогенов. Соединения галогенов со степенью окисления I во всех средах проявляют сильные окислительные свойства. Хлористая кислота слабая(HClO2) неустойчивая, существует только в разбавленных растворах. Она обладает сильнами окислительными свойствами. Степень окисления(5) -хлорноватая, НСЮз, бромноватая, НВгОз, йодноватая, HIОз, Кислоты НГОз — сильные электролиты, однако в ряду НСЮз, НВгОз, НЮз кислотные свойства несколько ослабевают. Окислительные свойства в ряду НСЮз, НВгОз, НЮз уменьшаются. степень окисления VII в кислотах НГО 4. Хлорная самая сильная из всех кислот. Хлорная кислота, как окислитель, гораздо менее активна, чем другие кислоты хлора и в растворах практически не проявляет окислительных свойств. Бромная кислота, НВГО 4, наименее устойчивая из кислот НГО 4, существует только в водных растворах (w < 55 %), по свойствам близка к хлорной кислоте. Кислотные свойства йодной кислоты выражены значительно слабее, чем у хлорной кислоты. Оксиды галогенов получают косвенным путем. Известны следующие оксиды хлора: С120, СЮ2, (С10з)2, С1207. Оксид хлора(1) (хлорноватистый ангидрид) — газ желто-бурого цвета. Оксид хлора(1У) — газ желтого цвета. Оксид хлора(6), (С10з)2, — маслообразная жидкость красного цвета. Оксид хлора(7) — бесцветная маслянистая жидкость, является ангидридом хлорной кислоты. Для брома известны Вг20, Вг02 и ВгОз, существующие только в атмосфере озона. Оксид йода(5), I2O5, — белое кристаллическое вещество, обладает сильными окислительными свойствами.