ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ и ДИАГРАММЫСОСТОЯНИЯ
При определении процессов взаимодействия веществ или их фазовых превращений необходимо располагать критериями, позволяющими предопределять условия, при которых данный процесс будет протекать в нужном направлении, а также условия устойчивости (неизменности во времени) изготовленного материала при заданных внешних условиях. Такие критерии устанавливают с помощью термодинамики и статистической физики.
В термодинамике физическую или химическую систему описывают определенным количеством макро измеряемых параметров. Связи между этими параметрами и общие закономерности, которым они подчиняются, выводят на основе постулатов подтвержденных опытом.
Систематическое изложение термодинамики дается в специальном курсе. Здесь мы остановились только на тех понятиях, которые необходимы для понимания основ физико-химического анализа и фазовых диаграмм состояния
Прежде чем перейти к основам физико-химического анализа и диаграмм состояния чистых веществ и бинарных сплавов кратко остановимся на основных понятиях и определениях, которые будут встречаться в данном разделе.
Основные определения:
Термодинамическая система (ТС) (в литературе по физико-химическому анализу используют несколько определений):
· Это система, для которой справедливы начала термодинамики.
· Одно тело или совокупность тел, между которыми возможен теп-
лообмен и диффузия хотя бы одного сорта атомов. Размеры этих тел должны быть такими, чтобы можно было определять их температуру и давление как статистические параметры.
· Макроскопическое тело или несколько взаимосвязанных друг с другом макроскопических тел, находящихся в ограниченной части пространства, отделенной от всего остального пространства реальной или воображаемой оболочкой.
По определению ТС состоит из большого числа частиц. Практически достаточно сотен частиц, чтобы статистические закономерности явились определяющими в поведении системы (иногда даже меньше, например, в статистической теории ядра).
Для ТС характерна возможность состояния термодинамического равновесия, а, следовательно, и определенность понятия температуры как параметра состояния.
Окружающее ТС пространство со всеми содержащимися в нем телами называют средой.
Термодинамические системы бывают:
1. Изолированная (замкнутая) – нет обмена энергией и веществом.
2. Закрытая – взаимодействие только за счет обмена энергией.
3. Открытая – взаимодействие за счет обмена энергией и веществом.
Термодинамические системы делятся на:
Гомогенная система – это однородная система, в которой нет поверхностей раздела частей, различных по строению и свойствам.
Гетерогенная система – это неоднородная система, состоящая из отдельных частей, имеющих различные физические и химические свойства и отделенных друг от друга поверхностями раздела
Термодинамическое состояние – состояние термодинамической системы, определяемое значениями внешних параметров и температуры.
Конкретный выбор термодинамических переменных в качестве внешних параметров определяется тем, каким образом рассматриваемая система выделена из среды окружающих ее тел и других систем, например:
а). Система заключена в сосуд с непроницаемыми стенками. Параметрами, определяющими состояние системы являются:
· Число частиц – N.
· Внешние параметры, определяемые расположением внешних по отношению к данной системе тел (объем V, внешние поля x1,…..xк).
· Температура – Т.
Внутренние параметры -“сопряженные” величины, такие как функции N, V, xi, T:
· Химический потенциал μ;
· Давление Р;
· Обобщенные координаты Хi ;
· Энтропия.
Разделение на внутренние и внешние параметры условно.
б). Система заключена в “сосуд” с проницаемыми стенками, возможен переход частиц от рассматриваемой системы к окружающим ее системам и наоборот. Параметрами системы будут: μ, V, xi и T.
Варианты а) и б) являются равноценными.
Термодинамическое равновесие – состояние ТС, в котором ее параметры не меняются со временем и в системе отсутствуют потоки любого типа.
Термодинамическая система может находится в полном или частичном равновесии.
Полное равновесие, когда во всех частях ТС постоянны:
1. Температура – термическое равновесие.
2. Давление – механическое равновесие.
3. Химический потенциал – химическое равновесие.
Химический потенциал (μi) – равен приросту энергии системы при увеличении числа молукул компонента (i) на единицу:
μi = (dG/dni)nj≠i, Т, Р
При отсутсвии постоянства какого либо одного из перечисленных параметров система будет находится в частичном равновесии.
Фаза – это гомогенная система, находящаяся в термодинамическом равновесии. Гетерогенная система состоит из двух или более фаз.
Фазовое равновесие (ФР) – термодинамическое равновесие многофазной системы. Условия ФР в изолированной системе состоят в одинаковости условий существования каждой ее фазы (Р и Т во всех фазах должны быть равны, одинаковы μi каждого компонента во всех существующих фазах.
Фазовые превращения (фазовые переходы) (ФП) – переходы вещества из одной фазы в другую (газ↔ж., ж↔тв.тело и т.д.), т.е. переходы 1 и 2-го рода.
Фазы, образующие гетерогенную систему, разделены поверхностями раздела, при переходе через которые резко изменяются физические свойства вещества и (или) его химический состав. Следовательно, любое фазовое превращение (α↔β) должно сопровождаться скачкообразным изменением состава и (или) структуры, а также свойств вещества.
При равновесии фаз их свободные энергии Гиббса (G=Н -ТS) равны, поэтому изменение свободной энергии (G) при фазовом переходе происходит непрерывно.
Анализ условий равновесия показывает, что ФП возможны лишь для двумерных и трехмерных систем. В случае одномерных систем, т.е. систем, в которых частицы расположены вдоль линии, равновесие двух фаз, а, следовательно, и фазовые переходы невозможны.
Физико – химический анализ
Для определения природы и свойств продуктов взаимодействия используют следующие методы:
1. Кристаллохимические исследования. Возможности кристаллохимии довольно ограничены и применимы, гл. обр., к фазам постоянного состава.
2. Препаративный метод требует выделения и изучения каждой фазы в чистом виде, что крайне трудоемко, а часто просто невозможно.
3. Метод физико-химического анализа (Ф-ХА) позволяет устанавливать состав и природу образующихся в системе фаз, не выделяя и не анализируя каждую отдельно.
Идея, лежащая в основе Ф-ХА, была высказана в 1752 г М.В. Ломоносовым в гл.9 его «Введения в истинную физическую химию» (М.В.Ломоносов, Полное собрание сочинений, т.2, М-Л., 1951, стр.572-575). Однако эта работа была опубликована только в 1904 г. и Ф-ХА возник независимо от нее только во второй половине Х1Х векаблагодаря работам Д.К.Чернова, Г.К.Сорби, Дж.В.Гиббса, Д.И.Менделеева, В.Ф.Алексеева, Д.П.Коновалова. На почве потребностей техники на рубеже Х1Х и ХХ вв. началось бурное развитие Ф-ХА, связанное с именами А.Ле Шателье, Ф.Осмонда, У.Робертса Остена, Г.Б.Розебома, Г.Таммана и особенно Н.С.Курнакова, которому принадлежат основополагающие теоретические и экспериментальные работы в этой области, а также сам термин «физико-химический анализ». В СССР работу Н.С.Курнакова продолжала и развивала созданная им большая научная школа.
Физико-химический анализ (Ф-ХА) – область физики и химии, изучающая посредством сочетания физических и геометрических методов прев-ращения, происходящие в равновесных системах.
В основе Ф-ХА лежит исследование зависимостей между составом системы (или другими параметрами состояния, например Т,Р) и величинами ее измеряемых свойств (электропроводность, твердость, показатель преломления и др.), число которых может достигать 25-30. Одними из важнейших методов современного Ф-ХА являются рентгеноструктурный и термический анализы. Найденные путем опыта соотношения между параметрами состояния и свойствами системы изображают графически в виде диаграмм состояния (ДС) и диаграмм состав – свойство (или, общее, параметр состояния - свойство).
Метод Ф-ХА заключается в изучении какого либо свойства многокомпонентной системы (сплава) в зависимости от ее состава, построении диаграмм “состав – свойство”, изучении геометрических особенностей этих диаграмм, поиске связи между геометрическими особенностями (формой) диаграмм и природой сплавов.
Из различных видов Ф-ХА при изучении сплавов часто используют термический анализ. С его помощью строят и изучают диаграммы состояния (диаграммы плавкости) или фазовые диаграммы.
Разработка материалов с нужными свойствами основывается на изучении изменений основных свойств в зависимости от состава смеси исходных материалов, приводимых во взаимодействие. Если обеспечить взаимодействие двух чистых веществ, то в зависимости от их природы, относительных количеств и условий взаимодействия (температура, давление) можно получить:
1. Фазы постоянного состава:
а). химические соединения, состав которых подчиняется правилам валентности, простых и кратных отношений;
б). интерметаллические соединения, состав которых не подчиняется законам валентности.
Интерметаллическое соединение (ИС) – соединение между металлами.
Металлическое соединение (МС) – самостоятельная (промежуточная) фаза сплава металлов между собой или с некоторыми неметаллическими элементами (Н, В, С, N, Si), обладающая металлической природой и свойствами. Понятия ИС и МС не тождественны, т.к., например, ИС Мg2Sn не обладает металлической природой и свойствами и поэтому не является МС. Между тем как ТiС, содержащий неметалл (углерод) – МС, но не является ИС.
2. Неоднородные смеси твердых фаз (механические смеси, кристаллические фазы которых могут быть разделены различными способами;
3. Фазы переменного состава или твердые растворы.
В кристаллическом состоянии различные вещества могут быть:
1. Полностью взаимно нерастворимы. В этом случае система состоит из кристаллов отдельных компонентов, т.е. каждый кристалл содержит только один компонент.
2. Обладать частичной (ограниченной) растворимостью. Кристаллы одного или большего числа компонентов могут содержать, наряду с основным компонентом, также и другие компоненты в количествах, не превышающих величины растворимости их в данных условиях.
3. Образовывать твердые растворы (внедрения, замещения, вычитания) с любым относительным содержанием компонентов. Кристаллы могут содержать два или большее число компонентов в любом относительном количестве, определяемом составом жидкой фазы.
По принятому определению, твердыми растворами называют такие твердые фазы, в которых соотношения между компонентами могут быть изменены без нарушения однородности.
До настоящего времени не установлено совокупности необходимых и достаточных условий для неограниченной взаимной растворимости элементов. На основании имеющегося экспериментального материала сформулированы лишь необходимые, но не всегда достаточные для этого условия:
1. Непрерывные ряды твердых растворов по типу замещения образуются между элементами, имеющими одинаковые кристаллические решетки.
2. Атомные радиусы и, следовательно, периоды кристаллических решеток сплавляемых элементов не должны отличаться более чем на 10 – 15%.
3. Электрохимические свойства (сродство к электрону) сплавляемых элементов не должны сильно различаться, иначе проявляется тенденция к образованию металлических соединений.
Правило фаз Гиббса
Термодинамическое равновесие системы зависит от многих переменных: количества компонентов, температуры, давления и др. При изменении этих параметров изменяются и условия равновесия: одни фазы будут исчезать, другие образовываться. Задача состоит в установлении связи между количеством компонентов, количеством фаз и числом независимых переменных, определяющих состояние равновесия.
Допустим имеется система, состоящая из одного или нескольких компонентов, даны параметры ее состояния (в частности Т и Р). Необходимо установить условия равновесия сосуществующих фаз.
Эту задачу решают применяя эмпирически установленное Гиббсом правило фаз, современный вывод которого основан на понятии о химическом потенциале и условиях термодинамического равновесия многокомпонентных систем.
Правило фаз выражается уравнением:
φ + v = к +2 (1)
где φ – число фаз;
v – число степеней свободы (вариантность);
к – число компонентов.
На практике часто встречаются два случая:
1). Если какой-нибудь параметр принимают постоянным (например Р=const), то число переменных уменьшается на единицу, что равноценно снижению на единицу числа степеней свободы и уравнение принимает вид:
φ + v = к +1 (2)
В этом виде оно применяется для построения диаграмм состояния системы, образованных нелетучими компонентами.
2). Если состояние системы, кроме Т, Р и концентраций, определяется еще одним параметром. Например, одна из фаз состоит из отдельных частичек настолько мелких, что нельзя пренебречь значением поверхностной энергии. Тогда добавочным параметром будет величина поверхности частиц и число степеней свободы увеличится на единицу. В этом случае уравнение примет вид:
φ + v = к +3 (3)
Поэтому равновесие между паром и жидкой фазой, состоящей из чрезвычайно мелких капелек (0,1 мкм – туман) будет иметь не одну степень свободы, а две.
В зависимости от числа степеней свободы системы могут быть:
v=0 - системы лишенные степеней свободы называются нонвариантными или инвариантными. Такие системы могут существовать лишь при строго определенных условиях, изменение хотя бы одного параметра вызывает исчезновение по крайней мере одной фазы.
v = 1 - система моновариантная. Только один параметр можно выбрать произвольно и это не изменит число фаз в системе.
v = 2 - система дивариантная.
Диаграммы состояния
В литературе диаграммы состояния (ДС) или фазовые диаграммы или диаграммы плавкости имеют несколько определений:
1. Диаграммы, выражающие зависимость температур начала и конца равновесной кристаллизации от состава;
2. Диаграммы, описывающие равновесное состояние физико-химической системы от химического состава и внешних условий;
3. Геометрическое изображение равновесных состояний вещества
при различных значениях параметров, определяющих эти состояния: температуры (Т), давления (Р), концентрации (Х).
Таким образом, диаграммы состояния дают информацию о характере фаз и фазовом составе вещества в зависимости от Т, Р, Х, а в ряде случаев от электрических (Е) и магнитных (Н) полей и других факторов воздействия на вещество.
Состояние однокомпонентных систем определяется двумя переменными параметрами (обычно Т и Р); его изображение (ДС) производится на плоскости.
Состояние двойных систем определяется тремя переменными параметрами (Т, Р и Х одного из компонентов); его изображение (ДС) производится в трехмерном пространстве.
Для тройных систем требуется четырехмерное пространство, т.к. число параметров состояния равно четырем (Т, Р и Х двух компонентов).
В общем случае для системы из n компонентов число параметров состояния N = n+1 и ДС дается в (n+1)-мерном пространстве.
При числе параметров больше двух для изображения ДС на чертеже ее проецируют на плоскость, выбираемую таким образом, чтобы некоторое число параметров (иногда их сумма) имело поспоянное значение. Чаще всего постоянным принимают давление Р (атмосферное) и получают изобарную ДС. При постоянной температуре Т получают изотермическую ДС, которая изображает зависимость между Р и концентрациями при постоянной Т. Изоконцентрационная ДС дает зависимость между Р, Т и концентрациями всех составных частей, кроме одной, концентрацию которой принимают постоянной. Системы, в которых отсутствует газообразная фаза (сплавы металлов, силикатов и др.) называются конденсированными, а их ДС – диаграммами конденсированного состояния. Зависимости между составом и измеримыми свойствами систем обычно изучают при постоянных Т и Р.
Геометрическое исследование ДС основано на двух общих положениях, введенных Н.С.Курнаковым:
1. Принцип непрерывности: при непрерывных изменениях параметров, определяющих состояние системы, свойства ее отдельных фаз изменяются непрерывно; свойства системы в целом изменяются также непрерывно, но лишь при условии, когда число ее фаз остается постоянным; в противном случае величины некоторых свойств (но не всех) могут претерпевать разрыв непрерывности.
2. Принцип соответствия: каждой фазе или каждому комплексу фаз отвечает определенный геометрический образ на ДС.
Точка на ДС, характеризующая состояние вещества при заданных параметрах (координатах этой точки) называется фигуративной. Ком-понентами систем для которых строят ДС, могут быть элементы, химические соединения, металлические и полупроводниковые материалы и др..
Основные типы ДС можно вывести теоретически, используя критерий свободной энергии. Однако ввиду того, что реальные системы не являются идеальными растворами, теорети
|
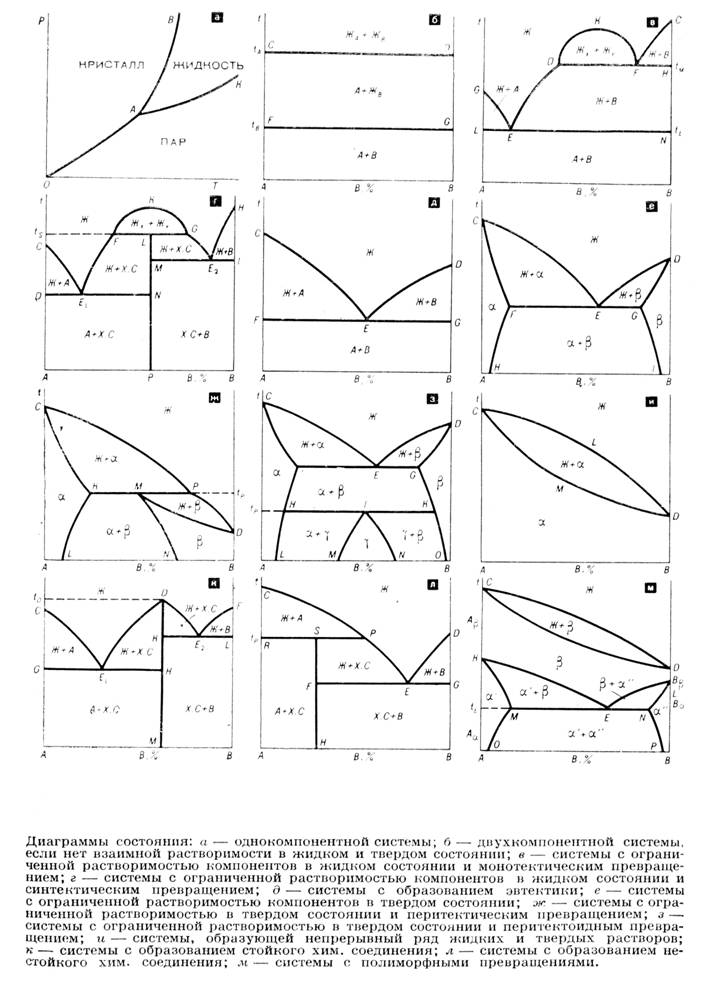
ческое исследование ДС позволяет только выявить общие закономерности. Реальные же ДС строят экспериментально, используя различные свойства сплава в зависимости от его состава методами физико-химического анализа.
Значение ДС состоит в том, что они позволяют делать точные выводы о физико-химической природе и границах существования фаз системы без их выделения и химического анализа. Знание ДС позволяет подобрать состав системы, наиболее удовлетворяющий требованиям практики, а также подходящие условия для проведения технологического процесса. Это объясняет широкое применение Ф-ХА во всех областях физики твердого тела и близких к ней теоретических и прикладных науках: металлургии, металлографии, технологии полупроводниковых и других новых материалов, минералогии и петрографии, геохимии и производстве синтетических аналогов драгоценных камней.