Все технологические процессы изготовления или модификации материалов основываются на изучении гетерогенных систем, поскольку каждый данный материал получают в результате либо фазового превращения паровой или жидкой фазы чистого вещества или раствора в кристаллическую фазу, либо химических или металлургических взаимодействий некоторых исходных веществ, из которых образуется требуемая фаза.
Наиболее полные сведения имеются для двухкомпонентных (бинар-ных, двойных) систем, образованных нелетучими компонентами. Для них построены фазовые диаграммы темпе ратура – состав при постоянном (главным образом, атмосферном) давлении.
При постоянном Р число степеней свободы бинарной (к=2) системы:
v = к + 1 – φ = 3 – φ (5)
Для построения ДС пользуются двумя взаимно перпендикулярными осями. На оси абсцисс откладывают состав Х системы, на оси ординат – температуры фазовых превращений (начала и конца кристаллизации, полиморфных превращений и др.), найденные посредством термического анализа, в частности записи кривых нагревания и охлаждения ряда смесей компо-
нентов изучаемой системы, взятой в различных соотношениях. Соединив нанесенные точки линиями, получают ДС при постоянном Р. Если же система изучается при переменном Р, то оно откладывают на третьей оси, перпендикулярной к осям Х и Т, и полученную трехмерную фигуру проектируют на плоскость.
Для построения ДС состав – свойство на оси абсцисс откладывают состав Х, а на оси ординат – значения свойства (плотности, электропроводности, твердости и др.) при постоянной Т. Соединив нанесенные точки линиями, получают изотермическую ДС состав – свойство (изотерму свойства).
Последовательно применяя общие принципы Ф-ХА, по виду ДС делают заключения о характере взаимодействия компонентов системы.
При рассмотрении будем считать, что все бинарные системы полностью растворимы в жидком состоянии. Необходимо установить, какие фазы могут образоваться при охлаждении жидких растворов любых составов.
Рассмотрим два простейших случая:
1. Компоненты А и В не образуют между собой ни твердых растворов, ни соединений, т.е. полностью нерастворимы друг в друге: системы с простой эвтектикой.
Эвтектика – сплав, находящийся в жидком состоянии в равновесии с кристаллами исходных компонентов, кристаллизующийся при постоянной температуре ТЕ (эвтектическая точка) и представляющий в твердом состоянии механическую смесь кристаллов исходных компонентов.
2. Компоненты А и В в твердом состоянии неограниченно растворимы друг в друге: твердые растворы.
Основные типы ДС двойных систем с непрерывным рядом твердых растворов установлены Б.Розебомом в 1899 г.
Двойные системы с простой эвтектикой
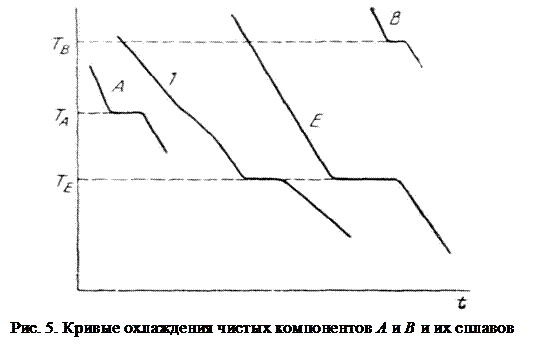
Кристаллизация чистых компонентов при постоянном давлении представляет собой нонвариантное равновесие, т.е. совершается при постоянной температуре. Это следует из правила фаз при Р=const (2):
v = к - φ + 1 = 1 – 2 + 1 = 0
Поэтому на кривых охлаждения чистых компонентов А и В (кривые А и В на рис. 5) наблюдаются горизонтальные участки, соответствующие температурам кристаллизации этих компонентов.
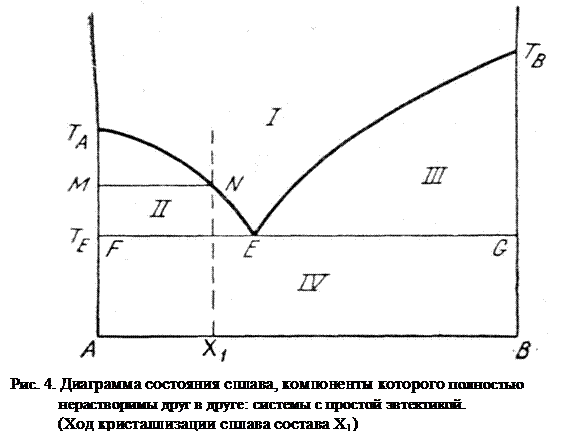
Рассмотрим ход затвердевания доэвтектического сплава, содержащего Х1 компонента А (Рис. 4).
Пока фигуративная точка находится в области жидкой фазы, он не претерпевает никаких фазовых превращений, вследствие чего понижение его температуры со временем происходит по плавной кривой. Когда жидкий раствор охладится до температуры начала кристаллизации (на кривой ТАЕ), он становится насыщенным по отношению к компоненту А. Из жидкости выпадает первый кристалл твердой фазы, имеющий состав чистого компонента А. Система становится двухфазной (жидкая + твердая, φ =2) и, следовательно, одновариантной:
v = к - φ + 1 = 2 – 2 + 1 = 1,
т.е. можно менять один параметр (температуру) и это не приведет к изменению фаз в системе. При этом происходит выделение теплоты кристаллизации, и скорость охлаждения замедляется: кривая охлаждения 1 (Рис.5) изменяет свой угловой коэффициент dT/dt и на ней появляется излом, соответствующий температуре выпадения первого кристалла компонента А. По мере
 | |||
 |
дальнейшего охлаждения количество кристаллов компонента А увеличивается, и оставшаяся жидкая фаза обогащается компонентом В, т.е. ее состав перемещается по линии ликвидуса в сторону эвтектики. Чтобы проследить за этим процессом, проведем для температуры Т<ТА изотермическую прямую MN, соединяющую фигуративные точки находящиеся в равновесии фаз. Левый конец этой прямой М указывает состав твердой фазы (компонент А), правый конец N – состав равновесной с ней жидкой фазы. Когда система охладится до эвтектической температуры, правый конец прямой придет в точку Е, т.е. жидкая фаза примет состав эвтектики.
Таким образом, кристаллизация доэвтектических растворов начинается выделением компонента А из жидкой фазы и заканчивается кристаллизацией эвтектики, т.е. происходит в некотором температутном интервале: верхняя граница определяется температурой начала кристаллизации компонента А и зависит от состава раствора, а нижняя лежит при температуре кристаллизации эвтектики.
Кристаллизация эвтектики протекает при постоянной температуре, как и кристаллизация чистых компонентов, поэтому на кривых охлаждения появляются горизонтальные участки, отвечающие нонвариантному равновесию (v = 0). На кривой охлаждения сплава эвтектического состава температура сначала плавно падает (кривая Е на рис.5). Когда сплав охладится до эвтектической температуры, жидкая фаза становится насыщенной обоими компонентами А и В, которые и начинают кристаллизоваться одновременно. В эвтектической точке Е существует равновесие между одной жидкой фазой эвтектического состава LЕ и двумя твердыми фазами SА и SВ, имеющими состав чистых компонентов, т.е. φ = 3. По правилу фаз число степеней свободы этой системы равно нулю:
v = к - φ + 1 = 2 – 3 + 1 = 0 (6)
Следовательно, эвтектика имеет постоянный состав и кристаллизуется (плавится) при постоянной температуре, что выражается горизонтальным участком на кривой охлаждения (кривой Е). По окончании кристаллизации эвтектики кривая охлаждения плавно идет вниз.
Из рис. 4 видно, что плоскость концентрационно-температурной диаграммы делится двумя кривыми температур начала кристаллизации ТАЕ и ТВЕ и эвтектической горизонталью FG на четыре фазовых поля. Из них только поле I, ограниченное снизу линией ликвидуса, однофазно; в его пределах существует лишь одна жидкая фаза, состав которой меняется от А до В. Между кривыми ликвидуса и эвтектической горизонталью находятся два двухфазовых поля – II и ΙΙΙ, в пределах которых жидкая фаза переменного состава находится в равновесии с одной твердой фазой постоянного состава – кристаллами А в поле II и кристаллами В в поле ΙΙΙ. Ниже эвтектической горизонтали имеем поле ΙV, в котором присутствуют две твердые фазы постоянного состава – кристаллы А и кристаллы В.
Согласно правилу фаз жидкие сплавы поля I имеют две степени свободы, а жидко-твердые системы полей II и ΙΙΙ, как и полностью отвердевшие системы поля ΙV, имеют одну степень свободы.
Полученный твердый сплав будет иметь следующую структуру: сравнительно крупные кристаллы компонента А, постепенно нараставшие при изменении состава расплава по кривой 1 (Рис. 5), вкраплены в твердую, состоящую из мелких кристаллов компонентов А и В, выделевшихся при эвтектической температуре.
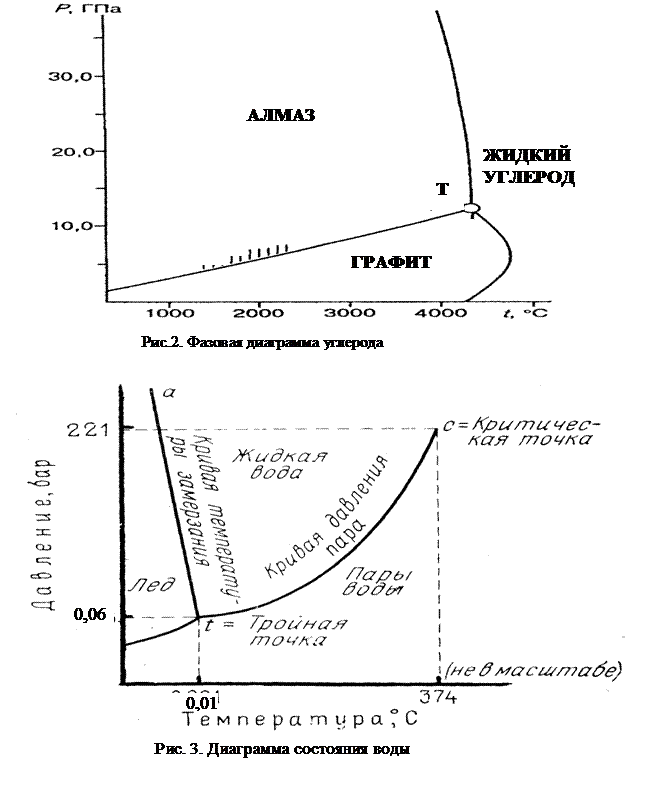
Необходимо отметить, что не существует систем, в которых компоненты были бы полностью не растворимы друг в друге. Существование диаграмм рассмотренного вида в справочниках объясняется тем, что авторы этих диаграмм не нуждались или не располагали методами точного анализа выделяющихся фаз. Чувствительные методы исследований показывают, что во всех случаях имеется хотя и очень малая, но взаимная растворимость элементов (Рис.3, е, з, м). Если бы действительно существовали системы компонентов, полностью нерастворимых друг в друге в твердом состоянии, то кристаллизация эвтектик позволила бы получать сверхчистые материалы.
Системы с неограниченной взаимной растворимостью в жидком и твердом состояниях.
Неограниченная взаимная растворимость элементов в твердом состоянии возможна лишь в том случае, если они принадлежат к одному структурному типу и если размеры их атомов близки по размеру (см. выше твердые растворы).
Температура начала кристаллизации твердого раствора может лежать и выше и ниже температуры кристаллизации чистых компонентов.
Также как и в рассмотренной выше двойной системе с простой эвтектикой кристаллизация чистых компонентов А и В при постоянном давлении представляет собой нонвариантное равновесие, т.е. совершается при постоянной температуре. Их кривые охлаждения показаны на рисунке 5 (кривые А и В).
Рассмотрим ход кристаллизации сплава, содержащего Х % компонента В (Рис. 6).
По мере охлаждения жидкого сплава от температуры Т его фигуративная точка М будет опускаться и при температуре Тℓ попадет на линию ликвидуса в точке ℓ.
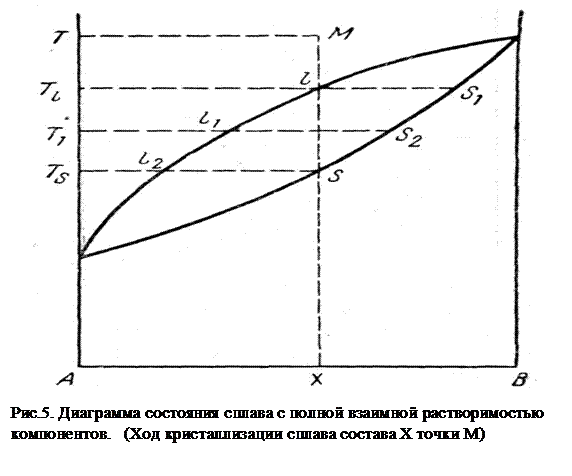 |
Проведенная от этой точки изотермическая прямая пересечет линию солидуса в в точке S1, т.е. состав первого выпавшего кристалла будет более богат компонентом В, чем исходный жидкий сплав состава Х. При дальнейшем охлаждении до температуры Т1 состав жидкой фазы изобразится абсциссой точки ℓ1, а состав равновесной с ней твердой фазы – абсциссой точки S2. Очевидно, что ранее выделившийся твердый раствор S1 уже не будет в равновесии с жидкой фазой ℓ1. Для достижения равновесия состав этого твердого раствора должен изменится таким образом, чтобы он отвечал абсциссе точки S2, т.е. обогатился компонентом А, что может произойти, например, путем диффузии. Далее при понижении температуры до Тs последние следы жидкой фазы будут иметь состав точки ℓ2, а твердый раствор к концу кристаллизации имеет состав равный составу исходной жидкости.
Таким образом, диаграмма состояния сплава с полной взаимной растворимостью компонентов (Рис. 6) делится кривыми ликвидуса и солидуса на три фазовых поля:
1. Поле I, ограниченное кривой ликвидуса, однофазно в его пределах существует лишь одна жидкая фаза, состав которой меняется от А до В. По правилу фаз число степеней свободы системы в этом поле равно двум:
v = к - φ + 1 = 2 – 1 + 1 = 2 (7)
2. Поле II ограничено кривыми ликвидуса и солидуса. Во всем интервале концентраций сосуществуют только две фазы: жидкая и твердая. По правилу фаз имеется одна степень свободы:
v = к - φ + 1 = 2 – 2 + 1 = 1. (8)
Система ни в одной точке не может стать нонвариантной. Следовательно, затвердевание сплава должно происходить не при постоянной температуре, а в некотором интервале температур. Поэтому кроме кривой начала кристаллизации – ликвидуса на диаграмме имеется также кривая конца кристаллизации – солидус. Отсутствие нонвариантных точек доказывает также непрерывность кривых ликвидуса и солидуса.
3. Поле III, ограниченное кривой солидуса, однофазно в его пределах существует лишь одна твердая фаза, состав которой меняется от А до В. По правилу фаз число степеней свободы системы в этом поле равно двум:
v = к - φ + 1 = 2 – 1 + 1 = 2 (9)
В случае непрерывного ряда твердых растворов затвердевшие сплавы при любом соотношении компонентов имеют однофазную структуру (поле III). Поэтому по микроструктуре твердые растворы неотличимы от других однофазных систем, т.е. простых и сложных чистых индивидов.
Характер взаимного расположения кривых ликвидуса и солидуса можно вывести теоретически, исходя из изотерм термодинамического потенциала; для каждой конкретной системы кривые ликвидуса и солидуса строят экспериментально.
Кривые ликвидуса и солидуса являются сопряженными: каждой точке кривой ликвидуса соответствует определенная точка кривой солидуса.
Диаграмма состояния позволяет определить количественное соотношение сосуществующих фаз и их концентрации при температуре Т<Тпл. Для этого достаточно провести изотермическую прямую, пресекающую кривые ликвидуса и солидуса. Абсциссы точек пересечения дают состав твердой и жидкой фаз. Эта прямая называется конодой. Конода соединяет фигуративные точки фаз, находящихся в равновесии при данной Т (например, отрезок ℓ1 S2 на рис. 6). Все точки коноды соответствуют смеси двух фаз. Количественное соотношение фаз определяется правилом «рычага»: весовые (объемные или молярные) количества фаз, находящихся в равновесии при данной температуре, обратно пропорциональны отрезкам коноды от точки, соответстующей составу вещества, до границ равновесия с каждой фазой (на рис. 6 количества жидкой и твердой фаз для точки С относятся при температуре Т1, как СS2 к ℓ1С).
Так как кристаллизация твердых растворов из жидкости протекает моновариантно (v = 1), т.е. в некотором температурном интервале, то на кривых охлаждения сплавов наблюдаются два изменения углового коэффициента dT/dt, один из которых отмечает начало, а другой – конец кристаллизации.
Рассмотренный нами ход кристаллизации соответствует идеальному случаю, когда затвердевающая система проходит ряд последовательных равновесных состояний, что практически невозможно соблюсти и, что приводит к неоднородности образовавшихся твердых растворов. Такая структурная неоднородность выражена тем сильнее, чем быстрее кристаллизация и больше ее температурный интервал.
Фазовые превращения твердых растворов ниже линии солидуса, наблюдаемые во многих системах, сопровождаются появлением новых фаз (Рис. 3, “м”).
Литература
1. М.Хансен. Структуры бинарных сплавов, пер. с нем., т. 1-2. М-Л., 1941.
2. С.А.Медведев. Введение в технологию полупроводниковых материалов. М., 1970, 504 с.
3. В.Я.Аносов. Основы физико-химического анализа. М., 1976.
4. Энциклопедия неорганических материалов, в 2-х т.. Киев 1977.
5. А.М.Захаров. Диаграммы состояния двойных и тройных систем. М.,1978.
6. Е.Н.Еремин. Основы химической термодинамики. М., 1978.
7. В.А.Киреев. Краткий курс физической химии. М. 1963.