В промышленности этен и другие алкены получают дегидрированием (пиролизом) алканов:
CH3–CH3 → t ° CH2=CH2 + H2
и крекингом углеводородов нефти:
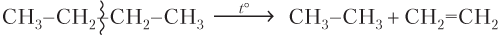
В лаборатории алкены можно получить:
· внутримолекулярной дегидратацией (отщеплением воды) спиртов в присутствии катализатора (если это H2SO4, то температура процесса должна быть выше 140 °C):
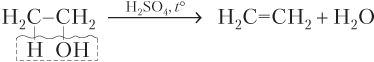
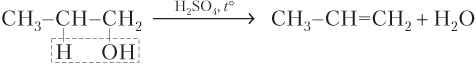
В случае спиртов несимметричного строения образуется смесь алкенов (см. конец данной главы):
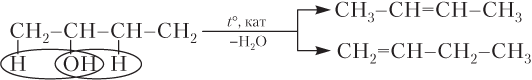
· дегидрогалогенированием (отщепление галогеноводородов) галогеналканов под действием спиртового раствора щелочи:
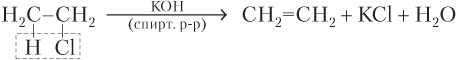
При дегидрогалогенировании галогеналканов несимметричного строения образуется смесь алкенов:
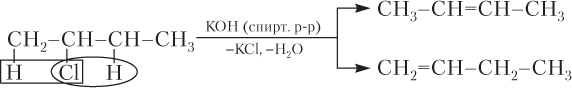
· дегалогенированием (отщеплением галогенов) дигалогенпроизводных алканов, содержащих атомы галогена у соседних атомов углерода:
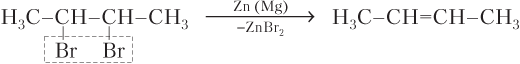
· гидрированием алкинов, диенов:
Pd/CaCO3, t °
R–C≡C–R′ + H2 R–CH=CH–R′
Ni
CH2=CH–CH=CH2 + H2 → CH3–CH2–CH=CH2
· Этилен можно получить деполимеризацией (разложением) полиэтилена:
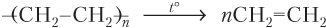
Пример 22.4. Запишите уравнения реакций всех известных вам способов получения пентена-1.
Решение. Записываем уравнения реакций всех возможных способов:
а) 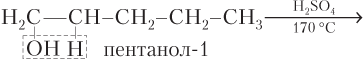
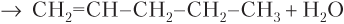
б) 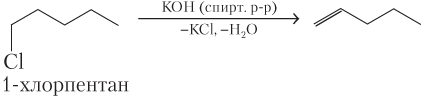
в) 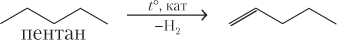
г) 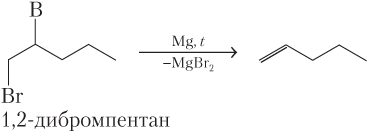
д) 

е) 
Пример 22.5. Запишите реакцию получения циклогексена-1 и опишите его химические свойства.
Решение. Записываем уравнения реакций получения циклоалкенов (принципиально они такие же, как и для алкенов):
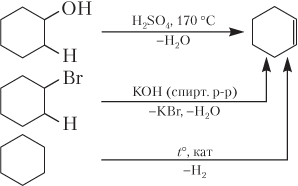
Подобно алкенам, циклоалкены вступают в реакции присоединения и окисления:
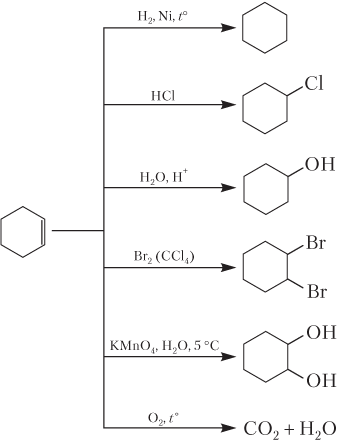
Наиболее широкое применение в промышленности находит этилен, который используется для получения уксусной кислоты, этанола, этиленгликоля, уксусного альдегида, этиленоксида, винилхлорида и поливинхлорида, разнообразных растворителей: 1,2-дихлорэтана (CH2Cl–CH2Cl); 1,1,1-трихлорэтана (CH3CCl3); перхлорэтилена (1,1,2,2-тетрахлорэтана), который используется для сухой химчистки.
Пример 22.6. Запишите уравнения реакций химических превращений согласно схеме
метан →1 ацетилен →2 этилен →3 этанол →4
→ этилен →5 хлорэтан →6 этилен.
Решение. Записываем уравнения реакций, соответствующих предлагаемой схеме:
1500 °C
1) 2CH4 CH≡CH + 3H2
Pd/CaCO3, t °
2) CH≡CH + H2 CH2=CH2
H+
3) CH2=CH2 + H2O → CH3–CH2OH
4) CH3–CH2OH −→−−−−−−H2SO4, 170 °C CH2=CH2 + H2O
5) CH2=CH2 + HCl → C2H5Cl
6) C2H5Cl −→−−−−−−−−KOH (спирт. р-р) CH2=CH2 + KCl + H2O
Правило Марковникова. Электронная плотность π-связи расположена над и под плоскостью кратной связи, поэтому она доступна для атаки другими реагентами и легко поляризуется (смещается) под влиянием заместителей. Поляризацию π-электронной плотности обозначают изогнутой стрелкой. Поляризация под влиянием электронодонорного (Д):
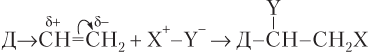
и электроноакцепторного (А) заместителя:
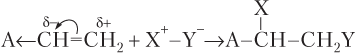
К электронодонорным заместителям относятся алкильные группы (–СН3, –С2Н5 и т.д.) и металлы; к электроноакцепторным — все группы, содержащие атомы с электроотрицательностью, большей, чем у атома углерода (–CF3, –CCl3, –CN, –CHO, –COOH, –NO2 и др.).
Считается, что электронное влияние атома водорода равно нулю (не проявляется). Поляризация электронной плотности π-связи приводит к тому, что молекула типа X+−Y− присоединяется по кратной связи так, что атом X+ присоединяется преимущественно к более (заместитель — донор электронов) или менее гидрогенизированному (заместитель — акцептор электронов) атому углерода двойной связи.
Молекулы XY — это вода (H+OH−), галогеноводороды (H+Cl−), кислоты (H+–CN−, CH3COO−–H+), спирты (CH3O−–H+) и др.
Данная закономерность была установлена русским химиком В.В. Марковниковым (1837−1904) и названа его именем (правило Марковникова).
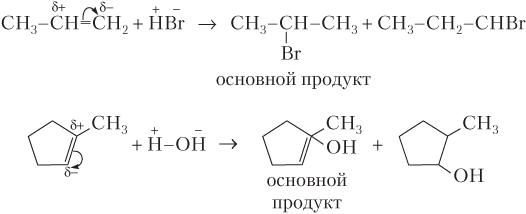
Примеры реакций присоединения галогеноводородов и воды, происходящих:
· по правилу Марковникова:
· против правила Марковникова:
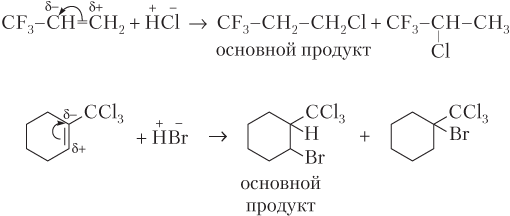
Правило Марковникова можно объяснить и с позиций устойчивости карбкатиона. Учтем, что взаимодействие молекул HX с алкенами протекает по ионному механизму и начинается с «атаки» Н+-иона на электроны π-связи (электрофильное присоединение A E). Это приводит к разрыву π-связи и образованию карбкатиона (обратите внимание, что положительный заряд возникает не на атоме углерода, к которому присоединился Н+-ион, а на соседнем), причем таких карбкатионов может быть два:
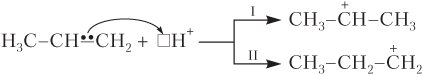
Более устойчивым является карбкатион I, так как в нем избыточный положительный заряд уменьшается за счет электронодонорного влияния двух (а не одной, как в карбкатионе II) алкильных групп. Далее карбкатион I быстро реагирует с отрицательно заряженной частью реагента НХ:
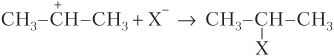
Понятно, что в ряду карбкатионов — первичный, вторичный, третичный
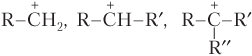
устойчивость карбкатионов растет.
Скорость реакций галогеноводородов с ненасыщенными соединениями растет при переходе от HF к HI (возрастает сила кислоты, а следовательно, и концентрация ионов H+). Электронодонорные заместители при кратной связи увеличивают скорость реакций алкенов с молекулами типа НХ, а электроноакцепторные — уменьшают, поскольку они соответственно увеличивают и уменьшают электронную плотность кратной связи.
Правило Зайцева. Русский химик-органик А.М. Зайцев (1841–1910) установил, что при получении алкенов из спиртов или галогенпроизводных алкенов атом водорода отщепляется преимущественно от менее гидрогенизированного атома углерода (т.е. связанного с меньшим числом атомов H):
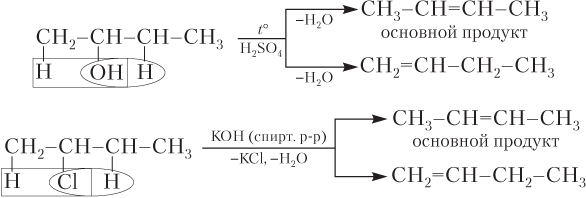
Такое течение реакции объясняется тем, что энергия связи С–Н неодинаковая для первичного (410 кДж/моль), вторичного (395) и третичного (380 кДж/моль) атомов углерода. Следовательно, легче других отрывается водород от третичного (наименее гидрогенизированного) атома углерода, а с наибольшем трудом — от первичного (наиболее гидрогенизированного).