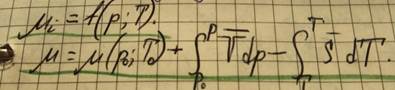Статистическая трактовка второго закона термодинамики. Формула Больцмана.
Соотношения между термодинамическими величинами устанавливаются с помощью законов термодинамики.
Объект, который рассматривается в статистической термодинамике – макроскопическая термодинамическая система.
Поскольку она макроскопическая, она состоит из огромного количества микрочастиц.
Все эти микрочастицы движутся в пространстве и взаимодействуют друг с другом.
Состояние каждой микрочастицы описывается некоторым набором микроскопических параметров.
Если бы у нас была возможность зафиксировать эти параметры для каждой частицы, то тогда бы мы полностью описали микроскопическое состояние системы.
Система непрерывно переходит из одного микросостония в другое. Это означает, что с течением времени микроскопические параметры меняются.
Наиболее строго, последовательно и точно микроскопические состояния описываются с помощью квантовой механики путём решения уравнения Шрёдингера, в котором фигурирует волновая функция.
Кроме того, фигурирует соотношение неопределенности Гейзенберга.
Данное соотношение запрещает одновременно, сколь угодно точно узнать координаты и проекции импульса.
Может быть так, что при изменении микроскопической системы е макросостояние не изменится. Тем самым можно представить, что заданное макроскопическое состояние реализуется огромным количеством способов на микроскопическом уровне.
Энтропии системы в статистической термодинамике напрямую связывается с тем количеством микроскопических способов, посредством которых реализуется данное макроскопическое состояние.
Статистическое определение энтропии основано на идее о том, что необратимые процессы в термодинамике вызваны переходом в более вероятное состояние, поэтому энтропию можно связать с вероятностью:
S = k lnΩ – формула Больцмана.
Ω = f (E;N) – число микроскопических способов (статистически вес), с помощью которых реализуется макроскопическое состояние.
k = const – константа Больцмана (R / NA).
S = ΣSi;
Ω = ΠΩi S ~ lnΩ
Формула Больцмана носит общий характер.
Для установлении численного значении k рассчитывают изотермически расширяющийся идеальный газ:
n = моль; N = N ≈ 6* 10 23 штук
V2 = mV1; m – целое число
ΔS = R ln (V2/V1) = R lnm = K lnΩ2 – K lnΩ1 = … = k ln [N] – km ln[(N/m)] = lnX = X lnX – X – формула Стирлинга.
= kN lnm.
Расширение идеального газа осуществляется обратимо → в любо момент времени система внутри себя находится в равновесии.
Можно доказать, что равновесному состоянию отвечает равновесное распределение молекул по чекам.

Когда все молекулы сосредоточены в одно чеке объемом V1, термодинамическая вероятность Ω = 1.
С увеличением числа молекул и числа доступных уровней энергии термодинамическая вероятность резко увеличивается, так что для обычных молекулярных систем при повышении температуры и разупорядоченности энтропия возрастает.
В изолированно системе энтропии либо не меняется, либо возрастает до max. Возрастание энтропии в изолированно системе объясняется тем, что статистический вес неравновесных состояний меньше, чем статистический вес равновесного состоний.
Сказанное выше справедливо для макроскопической системы. Энтропии системы возрастает в среднем (на достаточно больших временных интервалах).
В системе на микроскопическом уровне возможны флуктуации (случайные изменении параметров), в следствии которых система может переходить из более вероятного в менее вероятное состояние, но целом происходит наоборот.
Статистическая термодинамика объясняет значение термодинамики и принцип неубывания энтропии системы.
Характеристические функции и термодинамические потенциалы.
Характеристическая функция – такая функция состояния некоторых независимых параметров, с помощью которых, а так же её производных по параметрам, можно выразить все термодинамические свойства системы.
Характеристические функции, по определению, содержат в себе всю термодинамическую информацию о системе.
Каждая функция состояния может быть характеристической.
Характеристические функции получают, объединяя 1 и 2 законы термодинамики:

Все эти потенциалы не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
Теперь можно каждом случае убедиться, что функции характеристические и вывести соотношении, определенные величинами и заданные формулами.
Характеристическая функция называется термодинамическим потенциалом, если её убыль / прибыль в некотором равновесном процессе, который протекает при постоянстве соответствующе пары параметров, равна полно работе системы.
Убыль – полна работа системы за вычетом работы против воздествия.
Убыль термодинамического потенциала – полезна работа, проделываема системой.
Энергии Гиббса и другие функции становятся термодинамическими потенциалами при постоянстве соответствующих параметров.
Энтропия не входит в число потенциалов, т. к. е изменение не может быть равно полезно работе системы.
С помощью термодинамических потенциалов можно установить направление протекании обратимого процесса.
Любой термодинамический потенциал в необратимом процессе при постоянстве своих естественных переменных убывает и достигает min в состоянии равновесии.
Зависимость термодинамических потенциалов от их естественных переменных описывается соответствующими фундаментальными уравнениями Гиббса.
Система может обмениваться с окружающее средой не только энергией, но и веществом; может быть многокомпонентной. Тогда, учитывается массообмен:
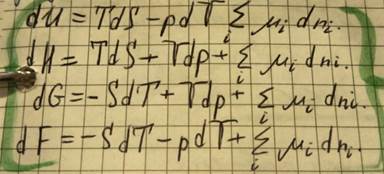
Наибольшее значение в практических термодинамических расчётах имеют энергия Гельмгольца и энергия Гиббса, т. к. их естественные переменные наиболее удобны для измерения и фиксации в ходе химических превращений.
23.Полные дифференциалы энергии Гиббса и Гельмгольца. Химический потенциал.

Химический потенциал показывает, как изменяется энергия Гиббса очень большой системы, если в неё внести / изъять 1 моль I – го вещества (парциальная молярная энергия Гиббса).
Химический потенциал относится к данному компоненту системы.
Каждый из них показывает, каким будет изменение соответственного термодинамического потенциала при изменении количества вещества I – го компонента, если поддерживаются постоянными естественные переменные данного термодинамического потенциала и количества вещества всех остальных компонентов.
Химический потенциал показывает, как изменяется внутренняя энергия.
Постоянство p и T позволяет определить μi как парциальную молярную энергию Гиббса.
Разность химических потенциалов является движущей силой массообменных процессов.
Один из признаков равновесия внутри системы – равенство химических потенциалов всех компонентов во всех частях системы.
μi – макроскопический параметр.
Если в системе один компонент, то химический потенциал – молярная энергия Гиббса данного компонента.
p;T = const.
(dG)p;T = (Σ μi dni) ≤ 0/
(Σ μi dni)p;T = 0 – условие равновесия.

Температурная зависимость выражается через -͞Si:

͞Vi – парциальный молярный объём.

Химический потенциал – однозначная функция T и p: