УГЛЕВОДОРОДЫ
Углерод образует огромное количество водородных соединений. Насчитывается около 6,5 млн органических веществ, и их число продолжает расти. Это объясняется тем, что атомы углерода способны соединяться между собой и образовывать различные цепи практически любого размера.
Углеводороды – это органические вещества, состоящие из двух элементов – углерода и водорода.
Нам уже известно строение молекул углеводородов: метана, пропана, бутана. Формула метана – СН4. Для атома углерода характерно свойство образовывать цепочки. Молекулы углеводородов могут представлять собой как линейные цепочки, так и разветвленные, и даже образовывать замкнутые циклы.
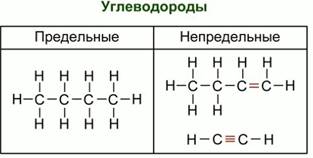
Вещества, имеющие одну и ту же молекулярную формулу, но различное химическое строение, и обладающие поэтому разными свойствами, называются изомерами (рис. 1).

| 
|
| Рис. 1. Примеры углеводородов и изомеров |
Между атомами углерода могут быть простые – одинарные связи. Это характерно для предельных углеводородов. В молекулах этих соединений все валентные связи полностью насыщены, поэтому они не способны к реакциям присоединения. Существует много углеводородов, сходных с метаном, т. е. гомологов метана (греч. «гомолог» – сходный). Каждый последующий углеводород отличается от предыдущего группой атомов – СН2 (гомологическая разность).
Углеводороды с общей формулой гомологического ряда СnH2 n+2, которые не присоединяют водород и другие элементы, называются предельными углеводородами или алканами (парафинами).
Если в молекулах углеводородов содержится двойная или тройная связь, то такие углеводороды называются непредельными или ненасыщенными (рис. 1).
|
|
Это алкены (общая формула гомологического ряда СnH2 n), алкины (общая формула гомологического ряда СnH2 n-2) и другие.
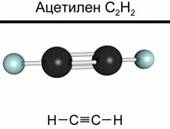
При изучении органических веществ мы часто будем пользоваться моделями молекул. На рис. 2 приведены шаростержневые модели молекул метана и ацетилена. В ней детали, изображающие атомы, соединены на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи. Такая модель дает наглядное представление о том, какие атомы с какими соединены, но она не передает относительных размеров и внешней формы молекул.
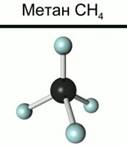
| 
|
| Рис. 2. Шаростержневые модели молекул метана и ацетилена |
Различие химических свойств предельных и непредельных углеводородов
Различие в строении предельных и непредельных углеводородов обусловливает и различие в химических свойствах. Например, этилен вступает в реакцию присоединения.

Рис. 3. Между левой и правой частями уравнения стоит стрелка, а не знак равенства. В органической химии принята такая запись уравнения реакции, чтобы не путать знак равенства с указанной двойной связью
Присоединение водорода к непредельным углеводородам называется реакцией гидрирования (см. рис. 3). Непредельные углеводороды присоединяют не только водород, но и галогены, галогеноводороды, воду.
С2Н4 + НСl → СH5Cl
Этен хлорэтан
Во всех органических соединениях углерод проявляет валентность, равную 4.
При повышенной температуре, давлении и в присутствии катализатора молекулы этилена соединяются друг с другом вследствие разрыва двойной связи.
Процесс соединения одинаковых молекул в более крупные молекулы называется реакцией полимеризации.
|
|

Рис. 4. Реакция полимеризации этилена
Индекс n означает, что звено (-СН2-СН2-) повторяется в ней n- ное число раз, где n – это степень полимеризации.
Для предельных углеводородов реакции присоединения не характерны, так как все валентные связи углерода и водорода полностью насыщены. Предельные углеводороды вступают в реакции замещения.
С2Н6 + Сl2 → СH5Cl + НCl
Этан хлорэтан
Все углеводороды хорошо горят. При горении выделяется большое количество теплоты, образуются углекислый газ и вода.
СН4 + 2О2 → СО2 + 2Н2О + Q
Реакции относятся к экзотермическим.
Физические свойства и нахождение в природе
Характеристика физических свойств углеводородов
С увеличением относительных молекулярных масс и количеством углерода в цепи, закономерно повышаются температуры кипения и плавления и агрегатное состояние углеводородов (рис. 5).
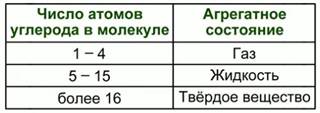
Рис. 5. Физические свойства углеводородов
Нахождение в природе
Простейший представитель предельных углеводородов – метан – образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха. Этим объясняется появление пузырьков газа в заболоченных водоемах. Иногда метан выделяется из каменноугольных пластов и накапливается в шахтах. Метан составляет основную массу природного газа (80-97 %). Он содержится в газах, выделяющихся при добыче нефти. Газообразные, жидкие и твердые предельные углеводороды содержатся в нефти.
Применение некоторых углеводородов
Для автогенной сварки и резки металлов используется газ – ацетилен С2Н2. Этот углеводород относится к непредельным углеводородам. В нем атомы углерода соединены тройной ковалентной связью (рис. 2). Так как реакции горения углеводородов являются сильно экзотермическими, то используют их в качестве топлива.
|
|
Полимеризацией этилена, пропилена получают полиэтилен и полипропилен. Из них изготавливают ценные пластмассы. Полиэтилен применяется при изготовлении упаковочных материалов, труб, игрушек, кабелей.