Санкт-Петербургский государственный
Электротехнический университет
«ЛЭТИ»
Кафедра физики
Исследование термодинамических циклов
Лабораторная работа № 10
Санкт-Петербург, 2012
Лабораторная работа 10
Исследование термодинамических циклов
Цель работы: исследование политропно-изохорно-изотермического (nVT) и адиабатно-изохорно-изотермического(SVT)циклов.
Приборы и принадлежности: баллон с воздухом, манометр, микрокомпрессор, лабораторные термометр и барометр.
Исследуемые закономерности
 Метод измерений. Используемая в работе установка изображена на рис. 2.1. Баллон А объёмом V 1 может сообщаться либо с насосом H, либо с атмосферой. Внутрь баллона помещён манометр М, измеряющий избыточное давление. Одно деление шкалы равно 4 мм вод. ст., что составляет 40 Па. Рабочим газом является воздух. В исходном состоянии параметры состояния воздуха следующие: давление p 2 и температура T 1. Диаграмма исследуемого цикла в координатах давления p и объёма V показана на рис. 2.2.
Метод измерений. Используемая в работе установка изображена на рис. 2.1. Баллон А объёмом V 1 может сообщаться либо с насосом H, либо с атмосферой. Внутрь баллона помещён манометр М, измеряющий избыточное давление. Одно деление шкалы равно 4 мм вод. ст., что составляет 40 Па. Рабочим газом является воздух. В исходном состоянии параметры состояния воздуха следующие: давление p 2 и температура T 1. Диаграмма исследуемого цикла в координатах давления p и объёма V показана на рис. 2.2.
Вначале насосом в баллон накачивают воздух до давления p 1= p 2 + D p 1 (состояние 1 (p 1; V 1)). При сжатии воздух нагревается, поэтому после закрытия крана необходимо выждать некоторое время, пока температура воздуха в баллоне не сравняется с температурой окружающей среды (при этом прекращается движение стрелки манометра).
 Затем воздух выпускают через кран К в атмосферу в течение нескольких секунд. Когда стрелка манометра приблизится к нулю, кран закрывают. В этот момент давление воздуха баллоне становится p 2(состояние 2 (p 2; V 2). Изменение параметров состояния воздуха в процессе расширения отражает линия 1 - 2, которая является политропой.
Затем воздух выпускают через кран К в атмосферу в течение нескольких секунд. Когда стрелка манометра приблизится к нулю, кран закрывают. В этот момент давление воздуха баллоне становится p 2(состояние 2 (p 2; V 2). Изменение параметров состояния воздуха в процессе расширения отражает линия 1 - 2, которая является политропой.
После закрытия крана охлаждённый при расширении воздух изохорически нагревается до температуры окружающей среды в результате теплообмена. Изменение параметров состояния воздуха отражает линия 2 - 3, которая является изохорой. Температура воздуха в баллоне становится равной температуре в точке 1 (T 3 = T 1), следовательно, точки 1 и 3 лежат на одной изотерме.
После выравнивания температур давление в баллоне изменится на D p 3 и станет p 3 = p 2 + D p 3 (состояние 3 (p 3; V 2)). Таким образом, D p 1и D p 3 - это изменения давления на участках 1 - 2 и 2 - 3. Участки 1 - 2 и 1 - 3 на диаграмме можно аппроксимировать прямыми, так как изменения параметров p, V, T в данной работе малы и много меньше абсолютных значений соответствующих величин.
В работе изучается политропно-изохорно-изотермический (nVT) цикл. Если процесс расширения газа на участке 1 - 2 рассмотреть как адиабатический, то получим адиабатно-изохорно-изотермический (SVT) цикл. Изучение циклов осуществляется путем их моделирования при значениях показателя адиабаты γ = 1,4 и показателя политропы n, полученным в результате измерений.
Определение показателя политропы. Первое начало термодинамики формулируется следующим образом: сообщённое системе количество теплоты d Q расходуется на увеличение внутренней энергии D U системы и совершение системой работы d А:
d Q = D U + d A = CV dT + p dV,
где CV – теплоёмкость газа при изохорном процессе.
nVT-цикл. Процесс расширения воздуха на участке 1 - 2 (рис. 2.1) является политропным, в котором теплоёмкость газа С остаётся постоянной. Первое начало термодинамики для политропного процесса имеет вид
 или CV ¢ dT + p dV = 0,
или CV ¢ dT + p dV = 0,
где C – теплоемкость воздуха в политропном процессе, CV ¢ = CV - C. Из этого соотношения с помощью уравнения состояния идеального газа можно получить уравнение Пуассона для политропного процесса TV n -1 = const или рV n = const, где n – показатель политропы,
n = (Cp - C) / (CV - C).
где  теплоемкости газа в изобарном и изохорном процессах.
теплоемкости газа в изобарном и изохорном процессах.
SVT-цикл. Предположим, что процесс расширения воздуха на участке 1 - 2 * (рис. 2.1) является адиабатным. Адиабатный процесс является одним из видов политропных процессов, он происходит без теплообмена с окружающей средой, d Q = 0 и теплоемкость газа в этом процессе С= 0. Поэтому показатель политропы в этом процессе равен  и называется показателем адиабаты. Взаимосвязь между параметрами состояния в адиабатном процессе также описывается уравнениями Пуассона либо объединенным газовым законом.
и называется показателем адиабаты. Взаимосвязь между параметрами состояния в адиабатном процессе также описывается уравнениями Пуассона либо объединенным газовым законом.
Показатель политропы n может быть определён экспериментально. Выразим n через экспериментально измеренные величины, для чего продифференцируем уравнения политропы (рVn = const) и изотермы (рV = const): рnV n -1 dV + V n dр = 0 - для политропы и рdV + V dр = 0 - для изотермы. Откуда
 ,
,  ,
, 
При относительно малых изменениях D p и D V угловые коэффициенты политропы 1 - 2 и изотермы 1 - 3 (см. рис. 2.1) рассчитывается по формулам
 ,
, 
где D V = V 2 - V 1. Из этих и приведенных выше соотношений получаем формулу
 (2.1)
(2.1)
Зная n, можно определить мольную теплоемкость газа в политропном процессе (мольные величины обозначаем соответствующими строчными буквами)
 (2.2)
(2.2)
где  показатель адиабаты, равный отношению теплоемкостей газа в изобарном и изохорном процессах,
показатель адиабаты, равный отношению теплоемкостей газа в изобарном и изохорном процессах,  число степеней свободы молекул газа, R= 8,31 Дж/(K×моль) – универсальная газовая постоянная. Воздух можно считать двухатомным газом, для которого при небольших температурах
число степеней свободы молекул газа, R= 8,31 Дж/(K×моль) – универсальная газовая постоянная. Воздух можно считать двухатомным газом, для которого при небольших температурах 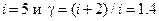
На участке 1 - 2 воздух охлаждается, а тепло через стеклянную колбу поступает в систему  ,поэтому теплопоемкость газа в политропном процессе
,поэтому теплопоемкость газа в политропном процессе  отрицательна. Это означает согласно формуле (2.2), что на участке 1-2 показатель политропы
отрицательна. Это означает согласно формуле (2.2), что на участке 1-2 показатель политропы  .
.
Расчёт холодильного коэфициента. Цикл, изучаемый в данной работе, является холодильным (ориентирован против часовой стрелки. Его эффективность принято характеризовать холодильным коэффициеном e, который определяется как отношение теплоты, отнятой от охлаждаемого газа, к затраченной в цикле работе. Для SVT -цикла с учетом  и
и  холодильный коэффициент e равен (обозначения цифровых индексов согласованы с рис. 2.2).
холодильный коэффициент e равен (обозначения цифровых индексов согласованы с рис. 2.2).
e (SVT) =  .
.
а для nVT - -цикла в предположении 
e(nVT)  .
.
Перепишем выражения для e, используя экспериментально измеряемые величины давлений, для чего значения работы А 12 и А 12* определим графическим способом. В рV- координатах (рис. 2.2) они равны площадям трапеций, основания которых р 1 и p 2 = р 2* (либо p 3 или р 3*), а высоты - (V 2 - V 1) и (V 2* - V 1) соответственно. Учитывая, что  и
и 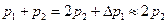 , получим
, получим
e (nVT) =  и e(SVT) =
и e(SVT) =  .
.
В проводимом опыте D p 3* больше, чем D p 3, поэтому отношение холодильных коэффициентов e (nVT)/ e (SVT) больше единицы.
Расчет изменения энтропии. Функция состояния, дифференциалом которой является отношение d Q / T, называется энтропией,

uде  мольная теплоемкость газа, зависящая от типа политропного процесса.(адиабатный, изохорный, изобарный и т.п.).
мольная теплоемкость газа, зависящая от типа политропного процесса.(адиабатный, изохорный, изобарный и т.п.).
Отметим, что данное выражение справедливо лишь для обратимых процессов.
Выразим изменение энтропии D S через экспериментально измеренные величины давлений сначала для nVT -цикла. В политропном процессе (на участке 1 - 2) с учетом уравнения Пуассона 

В изохорном процессе (на участке 2 - 3) изменение энтропии с учетом  и
и  , а также уравнения Пуассона равно:
, а также уравнения Пуассона равно:
D S 23 =  .
.
В изотермическом процессе (на участке 3 - 1)
D S 31 =  .
.
Для SVT -цикла изменение энтропии в адиабатном процессе (на участке 1 - 2 *) равно нулю. С учетом, что изменение энтропии в цикле также рано нулю, заключаем, что изменения энтропии в изохорном и изотермическом процессах равны по величине, но различаются знаком:
êD S 3*1 ê= 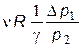 .
.
При расчетах учесть, что сумма изменений энтропии за цикл равна нулю.