Как же определить: кислотными или основными свойствами будет обладать то или иное соединение? Это совсем несложно, достаточно просто посмотреть Периодическую систему химических элементов Д.И. Менделеева.
Большинство химических элементов в таблице являются металлами, именно они и образуют основные оксиды, которым соответствуют основания. Однако, нужно знать, что если у металла степень окисления от +1 до +3, то оксид в таком случае будет основным, ему будет соответствовать основание, но если у металла будет высокая степень окисления, такая как +6, +7, то тогда его оксид будет проявлять кислотные свойства и соответствовать ему будет не основание, а кислота.


Например, у марганца (Mn) возможны степени окисления: +2, +4, +6, +7. Если в оксиде у марганца степень окисления +2, то такой оксид будет основным, если +4, то амфотерным, если +6 или +7, то такие оксиды будут кислотным. Поэтому, чем выше степень окисления элемента, тем ярче выражены кислотные свойства.

А что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка (Zn(OH)2) и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида цинка (ZnCl2) и добавим в каждую несколько капель раствора гидроксида натрия (NaOH). При этом можно наблюдать выпадение осадка белого цвета. Таким образом, мы получили гидроксид цинка реакцией обмена между хлоридом цинка и гидроксидом натрия.

Исследуем свойства гидроксида цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl), и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем раствора гидроксида натрия (NaOH), и в этом случае осадок тоже растворяется.
Какой же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и с основаниями, и с кислотами называются амфотерными. Они могут вести себя как кислоты в реакциях со щелочами и как основания в реакциях с кислотами. Т.е. в зависимости от условий они могут проявлять как кислотные свойства, так и основные. Значит, и записать химическую формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2 и в виде основания Zn(OH)2.
Давайте запишем уравнения этих реакций:

В первой реакции образуется соль хлорид цинка (ZnCl2), а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И цинк, и его оксид будут тоже амфотерными соединениями.
Например, цинк реагирует с кислотами: если в пробирку с цинком прилить серной кислоты (H2SO4), то будет выделяться газ. В результате этой реакции образуется соль – сульфат цинка (ZnSO4) и выделяется газ – водород (H2).
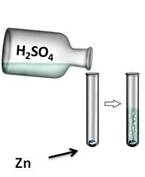
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H2↑
Цинк будет реагировать и со щелочами. Запомните, если реакция протекает в растворе, то образуется комплексная соль тетрагидроксоцинкат натрия ( Na2[Zn(OH)4] ), при сплавлении образуется соль – цинкат натрия ( Na2ZnO2 ), но водород выделяется в обоих случаях.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2NaOH = Na2ZnO2 + H2↑
Аналогично ведет себя и оксид цинка, т.е. он реагирует с кислотами и с основаниями.
Например, в реакции оксида цинка (ZnO) с соляной кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия, а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H+ = Zn2+ + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
А сейчас послушайте историю про двуличного Алюминия.
Жил да был на свете хитрец-наглец по имени Алюминий. Его владения находились между двумя могущественными королевствами. Одним королевством правил молодой жизнерадостный король Натрий. Все в его королевстве было голубым: чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые люди. Работалось и жилось в королевстве легко, свободно, радостно. А это вызывало сильную зависть у правительницы другого королевства – Серы. Она вся пожелтела от зависти и злобы, порой даже начинала плавиться от внутреннего жара или гореть лиловым пламенем. Наконец ее терпение лопнуло после одного пышного празднества, устроенного Натрием в честь рождения сына, и Сера объявила войну Натрию.
Натрий, никогда и никому не желавший зла, по характеру мягкий, как воск, хоть ножом его режь, не был готов к войне. Он обратился к Алюминию: «Помоги, ведь мы с тобой из одного семейства – металлов». Алюминий согласился, но решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и тем, и другим королевством.
Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Как видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным, значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий, как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой (H2SO4) он также образует соль – сульфат алюминия (Al2(SO4)3) и при этом выделяется газ – водород (H2).
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Алюминий реагирует и со щелочами: если реакция алюминия с гидроксидом натрия (NaOH) протекает в растворе, то в этом случае, как и в случае с цинком, образуется комплексная соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑

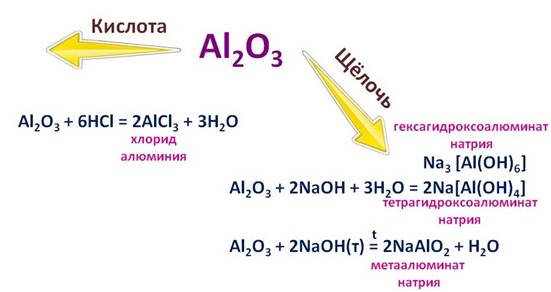
Оксид алюминия и его гидроксид ведет себя тоже двойственно. При реакции оксида алюминия (Al2O3) с соляной кислотой (HCl), он ведет себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3). А при взаимодействии с раствором щелочи, этот же оксид ведет себя как кислота, при этом образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), что будет верно в любом случае. А вот при сплавлении со щелочью, образуется соль – метаалюминат натрия (NaAlO2).
Гидроксид алюминия (Al(OH)3)тоже является амфотерным, поэтому он реагирует с кислотами и с основаниями.
Например, в реакции соляной кислотой (HCl), он себя ведет, как основание, при этом образуется соль – хлорид алюминия (AlCl3) и вода (H2O), а вот в реакции с гидроксидом натрия(NaOH), он ведет себя, как кислота. Если реакция протекает в растворе, то образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), а при сплавлении другая соль – метаалюминат натрия (NaAlO2).

Будьте внимательны, посмотрите амфотерные элементы в периодической таблице. Интересно, что элементы побочных подгрупп, в промежуточной степени окисления также могут проявлять амфотерные свойства, эти элементы еще называют переходными элементами или переходными металлами.